NONSEDA
 【論文】 Olsen HT, Nedergaard HK, Strøm T, Oxlund J, Wian KA, Ytrebø LM, Kroken BA, Chew M, Korkmaz S, Lauridsen JT, Toft P.
【論文】 Olsen HT, Nedergaard HK, Strøm T, Oxlund J, Wian KA, Ytrebø LM, Kroken BA, Chew M, Korkmaz S, Lauridsen JT, Toft P.
Nonsedation or Light Sedation in Critically Ill, Mechanically Ventilated Patients. N Engl J Med. 2020 Mar 19;382(12):1103-1111. doi: 10.1056/NEJMoa1906759. Epub 2020 Feb 16. PubMed PMID: 32068366.
【Reviewer】 Ryohei Yamamoto
【Summary】
- 北欧8施設による多施設オープンラベルRCTにより、酸素化目的の鎮静や腹臥位療法を必要としない成人人工呼吸患者において、無鎮静戦略と日々の鎮静中断を伴う浅い鎮静戦略を比較して90日死亡に差はなかった(42.4% vs 37.0%, MD, 5.4%; 95% CI, −2.2 to 12.2; P=0.65)
- 無鎮静戦略中の管理物(挿管チューブ、抹消ライン、胃管などのその他)の事故抜去は無鎮静群で多かった。
- 1:1看護の状況下でこのようなadverse eventがあるため、無鎮静戦略に不慣れな施設では浅い鎮静戦略の方が良いかもしれない。
- 本研究では、コミュニケーション、患者満足度、PTSD、看護師の負担、理学療法などのアウトカムは評価されていない。
- 正しく浅い鎮静戦略が行われる場合においては、90日死亡や人工呼吸期間、入院期間に大きな違いはなさそうであり、patients reported outcomeやcomedical reported outcome(Workloadなど)のバランスを鑑みて無鎮静戦略と浅い鎮静戦略を施設や患者毎に使い分けるのが理にかなっていると思われる。
【Research Question】
ICUに入室した人工呼吸患者において、無鎮静戦略は日々の鎮静中断を伴う浅い鎮静戦略と比較して90日死亡割合を改善するか
【わかっていること】
- 人工呼吸を要する患者では鎮静薬は標準的な治療となっている1。
- 技術の進歩により最新の人工呼吸器は患者にとってより快適なものとなったが、一般的に鎮静を人工呼吸管理中には行うべきと考えられてきた2 。
- しかしながら、ここ20年の研究によれば、鎮静薬の使用は人工呼吸患者のアウトカムを悪化させることが報告されている。
- 日々の鎮静中断と鎮静中断しないことを比較した試験では、日々の鎮静中断を行う患者群で人工呼吸期間が短く、ICU滞在期間が短いことが示されている3。
- 類似の試験では、日々の鎮静中断を行うことで死亡、入院期間の短縮が報告されている4。
- 単施設試験では日々の鎮静中断戦略よりも無鎮静戦略が、人工呼吸期間を短縮し、ICUまたは病院滞在期間を短縮することを報告している5 。この研究は統計学的検出力が足らず、死亡に関してはわからなかった。
- 事後解析では無鎮静群でAKIが少ないことがわかっている6。
【わかっていないこと】
- 無鎮静戦略は日々の鎮静中断を伴う浅い鎮静戦略よりも死亡を改善するか
【仮説/目的】
ICUに入室した人工呼吸患者において、無鎮静戦略は日々の鎮静中断を伴う浅い鎮静戦略と比較して90日死亡割合を改善する
【PICO】
P :24時間以上人工呼吸管理された18歳以上ICU患者
Inclusion Criteria:
- 18歳以上
- スクリーニング前に24時間人工呼吸管理されている
- 24時間以上の人工呼吸が予期されるもの
- 同意がある
Exclusion Criteria:
- 重症頭部外傷
- 低体温療法
- てんかん重積
- 前回試験参加者
- 48時間以上他ICUに滞在してからの転院患者
- 入室時昏睡(薬剤によるものではなく)
- 脳死
- PaO2/FiO2 9kilopascal以下
- 酸素化のため鎮静が必要もしくは腹臥位療法が必要
I :無鎮静戦略
C :日々の鎮静中断を伴う浅い鎮静戦略
O :90日死亡割合
【期間】 From January 2014 through November 2017
【場所】 デンマーク5施設 (Aarhus, Kolding, Esbjerg, Svendborg, and Odense)、ノルウェー2施設 (Tønsberg and Tromsø)、スウェーデン1施設(Linköping)
【デザイン】
- 事前プロトコルの有無 :あり、NCT01967680、BMC、 NEJM: protocol
- ランダム化の方法 :computer-generated, 中央割付、Variable Block size randomization.
層別化:participating center, age (≦65 years or >65 years), and the presence or absence of shock on arrival (systolic blood pressure, <70 mm Hg or ≧70 mm Hg) - 隠蔽化の有無 :中央割付
- マスキングの有無と対象者:Investigators, patients or their relatives, and physicians caring for the patients were aware of the trial-group assignments
(プロトコルに以下が記載:Due to the nature of the trial interventions, it will not be possible to blind the investigators at clinical trial sites, the participants, and the participants' relatives. All other parties in the trial will be blinded. Data regarding outcomes will be collected from national registers. The statistical analyses will be conducted blinded with the two intervention groups coded as, for example, A and B. Two conclusions will be drawn by the blinded steering committee; one assuming A is the experimental group and B in the control group, and one assuming the opposite. After that the code will be broken.) - インフォームド・コンセント:patient or the patient's closest relatives in accordance with national regulatory requirements.同意取り下げがあった場合、データだけ使わせてくれないか頼んだ。
- 資金:the Danish Medical Research Council, Danielsens Foundation, and the Scandinavian Society of Anesthesiology and Intensive Care Medicine.企業の資金提供はなし
【N】 710
【介入】 無鎮静戦略
- 基本的に鎮静薬は使用しない。
- 治療チームが必要と判断した場合に鎮痛としてモルヒネをボーラス投与で使用する。
- これらの患者は覚醒しており、コミュニケーションをとることができ、自然な睡眠リズムを維持することを目標とした。
- 非薬理学的(ReassuranceまたはMobilization)および薬理学的(鎮痛)治療の両方を行っても、患者を鎮静させる必要が生じた場合には、鎮静群で使用されたものと同様の鎮静薬(Propofol or Midazolam)を患者に投与する。
- 試験群間のクロスオーバーは認めない。
【対象】 浅い鎮静戦略
- 浅鎮静群の患者には、浅い鎮静、すなわち患者が覚醒可能なレベルであるRASS-2〜-3で管理することを目標に持続鎮静を行う。
- Richmond Agitation and Sedation Scale [RASS]のスコアは、-5[無反応]から+4[闘争的]で定義される8
- この介入は国際的なガイドラインと一致している9
- 鎮静に最初の48時間はpropofolが使用され、その後はmidazolamに置き換えられる。
- 毎朝、鎮静は完全覚醒を目指して中断。
- 完全覚醒は次の4つのタスクのうち少なくとも3つを実行できる能力と定義:口頭命令に応じて目を開く、目で指示に従う、要求に応じて手を絞る、要求に応じて舌を出す4
- 覚醒期間中に人工呼吸はウィーニング。
- 患者が前述の4つのタスクのうち3つを成功させた後、鎮静薬投与を中断前の半分の量で再開
- PEEPを5cmまで低下、FiO2を40%以下に低下できた場合、鎮静は再開しない
- これらの値は必ずしも抜管を示唆するものではない。
- これらの低い設定で患者が快適に覚醒したままでいられない場合は、鎮静を再開。
- また覚醒中に患者が不快になった場合は、鎮静再開。
- 鎮静の離脱に起因する不安または軽度の動揺のような症状は、クロニジンのボーラス用量で治療。
【両群共通】
- デクスメデトミジンの使用は両試験群で推奨しない。
- 両試験群とも、患者の疼痛治療のために、パラセタモールとオピオイドをボーラス投与する基本的な鎮痛レジメンを行った。
- 適切な場合には硬膜外麻酔を用いて疼痛をコントロール。
- 患者は、Confusion Assessment Method for the ICU(CAM-ICU)を用いて、1日に少なくとも2回(午前8時と午後8時)せん妄の評価を受けた11 。
- せん妄に対して治療が必要な場合、最初の選択は非薬理学的手段(安心感を与える、またはMobilization)を用いた。
- これでは不十分な場合、薬理学的治療が必要な場合は、ハロペリドールまたはオランザピンを使用した。
- 抜管後、患者は参加施設の通常の診療に従い、治療担当医師の判断でICUから退室
- 血栓予防法は両試験群ともに、参加施設の通常の方法に従って使用
【主要評価項目】
90日死亡割合
【副次評価項目】
- Days until death [ Time Frame: 1 year ]
- Days until death up to 90 days after randomization
- Thromboembolic events (pulmonary embolus or deep-vein thrombosis) up to 90 days after randomization
- Cardiovascular event [ Time Frame: 90 days ]
Proportion of participants with a major cardiovascular outcome (acute myocardial infarction, cerebral infarction, cerebral hemorrhage, pulmonary embolus, deep vein thrombosis, other thrombo-embolic event) at 90 days after randomization. - Coma and delirium free days [ Time Frame: 28 days ]
Number of coma- and delirium-free days (defined as RASS ≧ 3 and no positive CAM-ICU scorings the particular day) within 28 days from randomization - Highest RIFLE-score [ Time Frame: 28 days ]
- Days until discharge [ Time Frame: 28 days ]
- Days until discharge from ICU (within 28 days from randomization).
- Days until the participant is without mechanical ventilation [ Time Frame: 28 days ]
- Days until the participant is without mechanical ventilation (within 28 days from randomization).
【その他の事前規定のアウトカム】
- Mortality [ Time Frame: 28 days ]
- Discharge fro ICU [ Time Frame: 90 days ]
- End of mechanical ventilation [ Time Frame: 90 days ]
- Discharge from hospital [ Time Frame: 90 days ]
- Number of organ failures [ Time Frame: ICU-admission ]
- Accidental extubation [ Time Frame: ICU-admission ]
Number of accidental extubations requiring re-intubation within 1 hour - Accidental removal of a central venous line [ Time Frame: ICU-admission ]
Number of accidental removals of central venous lines, requiring re-insertion within 4 hours - Oxygenation [ Time Frame: During ventilator treatment ]
- 1-year survival [ Time Frame: 1 year from randomization]
【解析】
- サンプルサイズ計算
以前に行った人工呼吸患者における鎮静または無鎮静の単一施設ランダム化試験5からintention-to-treat解析における入院中の死亡割合は非鎮静群36%、鎮静群47%。無鎮静群でRRR25%であった。その他のメタアナリシスを含む研究では、人工呼吸患者の90日死亡割合は約40%であった14,15
これらの結果よりRRR25%、α0.05、β0.2として、700人の患者(各群350人)が必要と算出。 - ITTの有無 :modified ITT(同意撤回、一度も介入を受けなかったものを除外。同意撤回してもデータ利用可はそのままCensorとして扱う)
- 多重検定の対処:統計解析計画には、副次アウトカムを検定する際に多重比較を補正する規定を含めなかったため、副次アウトカムの結果は点推定値および未調整95%信頼区間として報告し、試験群間の差については結論を出さないこととした。
- 欠測の対処:Multiple imputation
- 主解析:multivariate logistic-regression analysis (層別因子で調整)
- 二次解析:unadjusted univariate logistic regression(90日死亡に対して)
- 探索的解析:multivariate logistic-regression analysis with adjustment for the randomization stratification factors and for Simplified Acute Physiology Score (SAPS) II, Sequential Organ-Failure Assessment (SOFA) score, shock at admission, chronic kidney disease, chronic obstructive pulmonary disease, and daily use of benzodiazepine before randomization(90日死亡に対して)
- 生存時間:Cox proportional-hazards regression, with and without adjustment for the randomization stratification factors and for other baseline clinical variables (additional details are provided in the statistical analysis plan).
【Results】
- フローダイアグラムの解釈(フォローアップ、除外)
2014年1月から2017年11月までに、合計2300人の患者がスクリーニングされ、710人の患者が本試験に登録された。無鎮静群354人、浅い鎮静群356人が無作為に割り付けられた。ランダム化後、10人の患者が除外され(除外の理由はFigure1)、Modified ITT解析では合計700人の患者が解析された。追跡調査で脱落患者はなく、700人の患者全員から主要アウトカムに関するデータを得た。副次的転帰に関しては、5%未満の患者で観察が欠測した。

- 集団特性(内的妥当性・外的妥当性)
- 年齢は70-72歳前後、女性36-41%、SOFA7-8、内科70%弱、肺炎もしくはARDSが42-43%を占める集団。
- APACHEIIスコアは、浅い鎮静群より無鎮静群の方が1ポイント高かった(26対25)こと,女性の割合が浅い鎮静群で多い(36.1 vs 41.9%)ことを除けば、患者の特徴は2つの群で同等であった(表1)
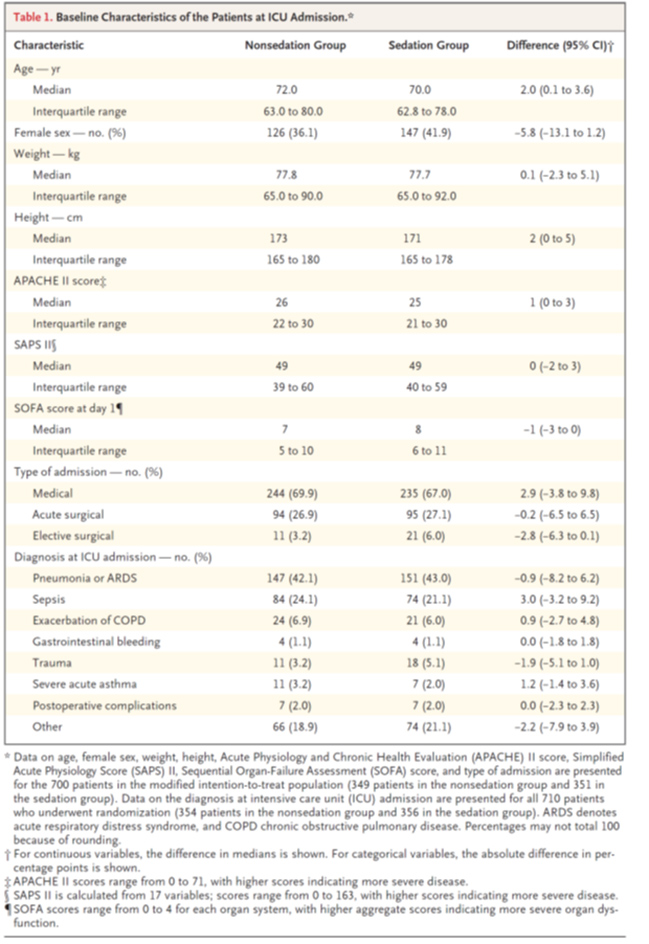
- アドヒアランス
- 浅鎮静群ではRASSはDay1 -2.3, Day7 -1.8で推移した。無鎮静群ではRASSはDay1 -1.3, Day7 -0.8であった。
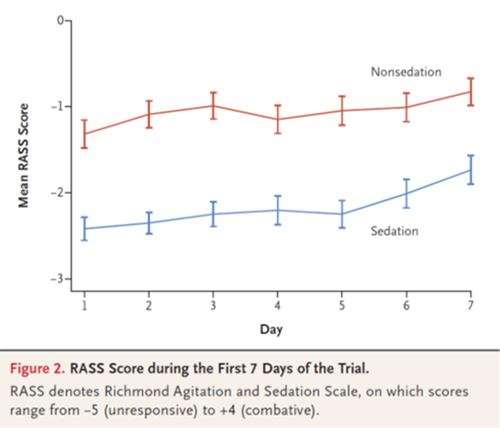
- 無鎮静群でDay1に27%が鎮静薬が使用され、ICU入室期間中に38.4%が少なくとも鎮静薬投与を受けた。鎮静薬投与の主な理由はせん妄であった。
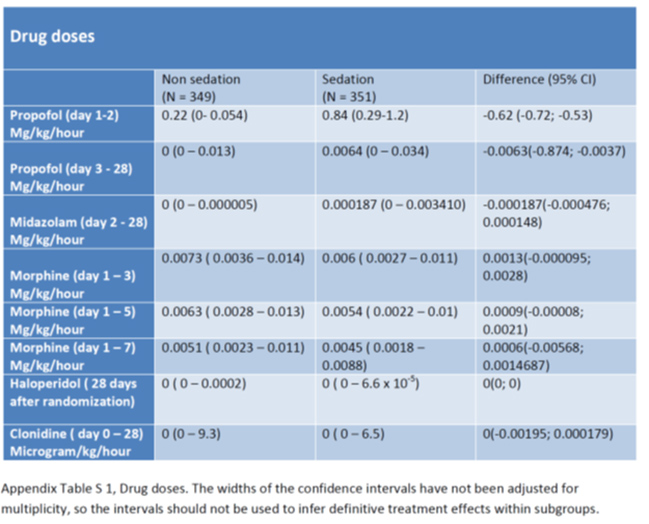
- プロポフォールおよびミダゾラムを含む鎮静剤の総投与量は、無鎮静群よりも鎮静群の方が高かった(表S1)。
- 最初の3日間のモルヒネの平均投与量は、無鎮静群では0.0073mg/kg/hr(range, 0.0036〜0.0140)、鎮静群で0.0060mg/kg/hr(range, 0.0027〜0.0110)(未調整RD、0.0013;95%CI、-0.0001〜0.0028)(表S1)
- 7日間すべてにおいて、モルヒネの平均投与量は、無鎮静群では0.0051mg/kg/h(range, 0.0023〜0.0110), 鎮静群では0.0045mg/kg/hr(range, 0.0018〜0.0088)であった。
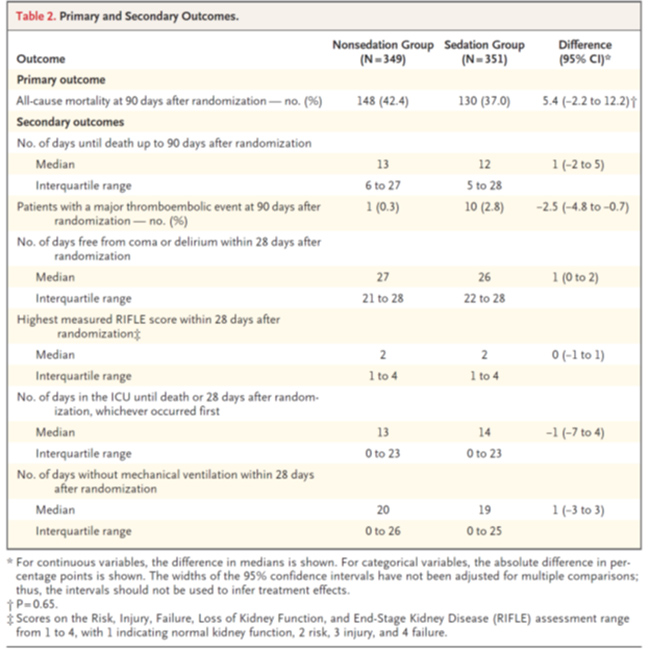
- 主要評価項目
90日死亡割合:無鎮静群148 (42.4%) vs 浅鎮静群130 (37.0%) (difference, 5.4 percentage points; 95% confidence interval [CI], −2.2 to 12.2; P=0.65) (Table 2 and Figure 3)
- 副次評価項目
- Days until death up to 90 days: 13 days (IQR 6 to 27) vs 12 days (IQR, 5 to 28) (unadjusted difference, 1 day; 95% CI, −2 to 5).
- Major thromboembolic event (pulmonary embolus or deep-vein thrombosis) within 90 days after randomization: 1 patient (0.3%) vs 10 patients (2.8%) (unadjusted difference, −2.5 percentage points; 95% CI, −4.8 to −0.7)
- 他のアウトカムで有意差なし。
- Days free from coma or delirium: 27 days vs 26 days
- Days free from coma or delirium: 3 (range, 1 to 6) vs 1 (range, 0 to 3)
- The highest measured RIFLE score within 28 days after randomization: 2 vs 2
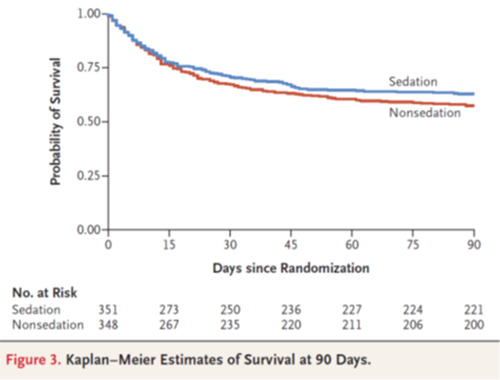
- Adverse Event
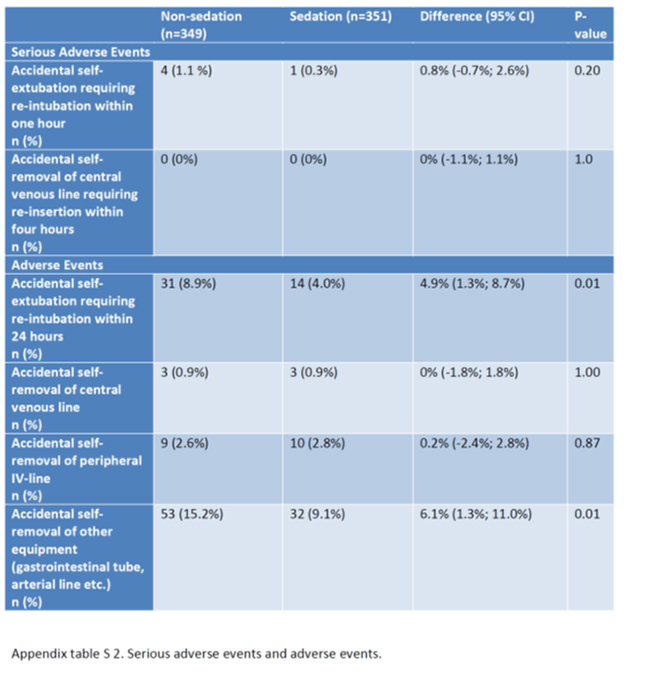
- 1時間以内に再挿管につながる偶発的な抜管事故: 4人(1.1%) vs 1人(0.3%)(RD, 0.8%ポイント;95%CI、-0.7〜2.6;P=0.20)
- いずれの試験群においても、4時間以内に中心静脈カテーテルを誤って抜去して再挿入に至った事象は発生しなかった。
有害事象は表S2に報告。
【Discussion】
- ICUの人工呼吸患者を対象とした、多施設ランダム化比較試験により、90日死亡割合は、無鎮静戦略と日々の鎮静中断を伴う浅い鎮静戦略とで有意差は認められなかった。
- 人工呼吸期間、ICU滞在期間、入院期間に両群間で有意差はなかった。
- 非昏睡や非せん妄期間は、無鎮静群の方が浅い鎮静群よりも1日多く、血栓塞栓イベントは無鎮静群で少なかった。
- RIFLEスコアは両群間で有意差はなかった。
- しかし、副次的転帰の多重比較に対する補正計画がないため、これらの観察から正しい推論を行うことはできなかった。
- 血栓塞栓症イベントの数が少ないのは、両試験群の全患者で予防的に低分子ヘパリンを使用したことで説明できるかもしれない。
- いくつかの試験では、浅い鎮静の結果、人工呼吸期間が短くなり、ICUまたは病院滞在期間が短くなることが示されている3,4,16 。
- しかし、本研究では人工呼吸期間やICUまたは病院滞在期間が両群間で有意差はなかった。
- 人工呼吸のための鎮静に関する最近の国際ガイドラインによると、RASSスコアが-2〜+1の場合は軽度の鎮静と定義されている2 。
- 最近ジャーナルに掲載されたSedation Practice in Intensive Care Evaluation (SPICE) III試験では、鎮静目標は軽度の鎮静であったが、両群とも40%以上の患者でRASSスコア中央値が-3〜-5であったと報告されている17。
- また、無鎮静群では、ランダム化後の最初の1 週間に鎮静が行われた患者の割合が前述の試験で報告されているよりも高く、鎮静の程度のグループ間差が意図したよりも低かったことも一因となっている18
- 非昏睡や非せん妄期間は、術後ケアにおける無鎮静と浅い鎮静を比較した臨床試験の結果と類似している。19
- 本研究では無鎮静群では事故抜管イベントが多かったが、1時間以内に再気管内挿管に至ったものはほとんどなかった。本研究で事故抜管が少なかったのは、参加しているほとんどのICUで看護師と患者の比率が1:1であったためかもしれない。
【Strength・Limitation】
- Strength :系統的な記載なし
- Limitation :系統的な記載なし
【論文の結論】
ICUで人工呼吸を受けている重症成人患者において、無鎮静戦略と日々の鎮静中断を伴う軽い鎮静戦略の間に有意な差はなかった。無鎮静戦略では人工呼吸日数やICU、入院期間に重要な差はなかった。
- 飛躍していないか
ない
【批判的吟味】
<内的妥当性>
- 多施設RCT
- スクリーニングで約14%が参加拒否しており選択バイアスがあるかもしれない。
- ランダム化、隠蔽化、群間差に問題なし(女性が鎮静群で多いのはやや懸念)
- マスキングはできないがアウトカム評価者、解析者はMaskingされていると考える
- 研究の逸脱として無鎮静群で鎮静薬使用はDay1 27%, ICU入室期間中に38.4%がある。(使用の理由はAgitationか酸素化がほとんど)。これは研究の背景によって、意図した介入から逸脱したものではない。
- 浅鎮静群ではRASSはDay1 -2.3, Day7 -1.8、無鎮静群でDay1 -1.3, Day7 -0.8とRASSの大きな違いがない。比較しても差がでないだろう集団になっている。
- 90日死亡のアウトカムはほとんどすべてが利用可能である。
- アウトカム評価者はマスキングされていると考えられ、またされていなかったとしても客観的である。
- Secondary outcomeに関しては2013年と2014年で変更されているがPrimary Outcomeに変更はない(See NCT01967680)
<90日死亡に対するRoB2.0>

<外的妥当性>
- 肺炎もしくはARDSが42.1 vs 43%の集団。
- ほとんどが肺炎かARDSであるが除外基準で酸素化や腹臥位療法が必要な集団は除外されている。おそらくmildARDSや酸素化はさほど悪くない肺炎をみている。とはいっても患者特性にPaO2, FiO2, PEEPなどの情報がほしかった。
- 浅い鎮静管理でも-2〜-3を目指して-2.3〜-1.8になる集団
- 看護師:患者の配置比率が1:1
- 【Implication】
- 酸素化目的の鎮静や腹臥位療法を必要としない成人人工呼吸患者において、無鎮静戦略と日々の鎮静中断を伴う浅い鎮静戦略を比較して90日死亡に差はなかった(42.4% vs 37.0%, MD, 5.4%; 95% CI, −2.2 to 12.2; P=0.65)
- 点推定値は浅い鎮静に良い方向によっているのが気になるところではあるが、偶然誤差の可能性があり、他の研究と総合的に考えるべきである。
- そもそもdaily interruptionを行う浅い鎮静のRASSは無鎮静と1程度しか違わず、無鎮静群でも必要時は鎮静薬を使用しているため、差がでないような集団であった可能性がある。
- RRR25%の見積もりは大胆であり、本当に90日死亡の差を見たければ、ARR5.4%でのRCTが必要であるが、サンプルサイズが多くなかなか実行困難でろう。
- ということで、本研究結果からは無鎮静と浅い鎮静では90日死亡に差はないと考えて話をすすめるのが良いだろう。
- Secondary outcomeに関しては多重検定への対処ができていないため正しく推論することが難しいが、正しく浅い鎮静戦略が行われれば非昏睡、非せん妄期間が少なく、他は変わらないというのは、無鎮静戦略を普段の診療としている身としては概ね、臨床感覚に近い印象をうける。
- 無鎮静戦略中の管理物(挿管チューブ、抹消ライン、胃管などのその他)の自己抜去は無鎮静群で多いことは注意を要する。1:1看護の状況下でこのようなadverse eventがあるため、無鎮静戦略に不慣れな施設は浅い鎮静戦略の方が良いかもしれない。
- 今回、コミュニケーション、患者満足度、PTSD、看護師の負担、理学療法などのアウトカムは評価されていない。
- これらのpatients reported outcome(PRO)やco-medical staff reported outcome(reviewerの造語、コメディカルのworkloadなど)のバランスを鑑みて無鎮静戦略と浅い鎮静戦略を使い分けるのが理にかなっていると思われる。
【本文サイト】
https://www.nejm.org/doi/full/10.1056/NEJMoa1906759
【もっとひといき】
SPICE-3
【引用】
- Petty TL. Suspended life or extending death? Chest 1998;114:360-361.
Crossref. opens in new tab
Web of Science. opens in new tab
Medline. opens in new tab
Google Scholar. opens in new tab- Devlin JW, Skrobik Y, Gélinas C, et al. Clinical practice guidelines for the prevention and management of pain, agitation/sedation, delirium, immobility, and sleep disruption in adult patients in the ICU. Crit Care Med 2018;46(9):e825-e873.
Crossref. opens in new tab
Web of Science. opens in new tab
Medline. opens in new tab
Google Scholar. opens in new tab- Girard TD, Kress JP, Fuchs BD, et al. Efficacy and safety of a paired sedation and ventilator weaning protocol for mechanically ventilated patients in intensive care (Awakening and Breathing Controlled trial): a randomised controlled trial. Lancet 2008;371:126-134.
Crossref. opens in new tab
Web of Science. opens in new tab
Medline. opens in new tab
Google Scholar. opens in new tab- Kress JP, Pohlman AS, O'Connor MF, Hall JB. Daily interruption of sedative infusions in critically ill patients undergoing mechanical ventilation. N Engl J Med 2000;342:1471-1477.
Free Full Text
Web of Science. opens in new tab
Medline. opens in new tab
Google Scholar. opens in new tab- Strøm T, Martinussen T, Toft P. A protocol of no sedation for critically ill patients receiving mechanical ventilation: a randomised trial. Lancet 2010;375:475-480.
Crossref. opens in new tab
Web of Science. opens in new tab
Medline. opens in new tab
Google Scholar. opens in new tab- Strøm T, Johansen RR, Prahl JO, Toft P. Sedation and renal impairment in critically ill patients: a post hoc analysis of a randomized trial. Crit Care 2011;15:R119-R119.
Crossref. opens in new tab
Web of Science. opens in new tab
Medline. opens in new tab
Google Scholar. opens in new tab- Toft P, Olsen HT, Jørgensen HK, et al. Non-sedation versus sedation with a daily wake-up trial in critically ill patients receiving mechanical ventilation (NONSEDA Trial): study protocol for a randomised controlled trial. Trials 2014;15:499-499.
Crossref. opens in new tab
Web of Science. opens in new tab
Medline. opens in new tab
Google Scholar. opens in new tab- Sessler CN, Gosnell MS, Grap MJ, et al. The Richmond Agitation-Sedation Scale: validity and reliability in adult intensive care unit patients. Am J Respir Crit Care Med 2002;166:1338-1344.
Crossref. opens in new tab
Web of Science. opens in new tab
Medline. opens in new tab
Google Scholar. opens in new tab- Barr J, Fraser GL, Puntillo K, et al. Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit. Crit Care Med 2013;41:263-306.
Crossref. opens in new tab
Web of Science. opens in new tab
Medline. opens in new tab
Google Scholar. opens in new tab- Fonsmark L, Hein L, Nibroe H, et al. Danish national sedation strategy: targeted therapy of discomfort associated with critical illness. Dan Med J 2015;62:C5052-C5052.
Web of Science. opens in new tab
Medline. opens in new tab
Google Scholar. opens in new tab- Ely EW, Margolin R, Francis J, et al. Evaluation of delirium in critically ill patients: validation of the Confusion Assessment Method for the Intensive Care Unit (CAM-ICU). Crit Care Med 2001;29:1370-1379.
Crossref. opens in new tab
Web of Science. opens in new tab
Medline. opens in new tab
Google Scholar. opens in new tab- Mehta RL, Kellum JA, Shah SV, et al. Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury. Crit Care 2007;11:R31-R31.
Crossref. opens in new tab
Web of Science. opens in new tab
Medline. opens in new tab
Google Scholar. opens in new tab- Colantuoni E, Dinglas VD, Ely EW, Hopkins RO, Needham DM. Statistical methods for evaluating delirium in the ICU. Lancet Respir Med 2016;4:534-536.
Crossref. opens in new tab
Web of Science. opens in new tab
Medline. opens in new tab
Google Scholar. opens in new tab- Afshari A, Wetterslev J, Brok J, Møller A. Antithrombin III in critically ill patients: systematic review with meta-analysis and trial sequential analysis. BMJ 2007;335:1248-1251.
Crossref. opens in new tab
Medline. opens in new tab
Google Scholar. opens in new tab- Perner A, Haase N, Guttormsen AB, et al. Hydroxyethyl starch 130/0.42 versus Ringer's acetate in severe sepsis. N Engl J Med 2012;367:124-134.
Free Full Text
Web of Science. opens in new tab
Medline. opens in new tab
Google Scholar. opens in new tab- Brook AD, Ahrens TS, Schaiff R, et al. Effect of a nursing-implemented sedation protocol on the duration of mechanical ventilation. Crit Care Med 1999;27:2609-2615.
Crossref. opens in new tab
Web of Science. opens in new tab
Medline. opens in new tab
Google Scholar. opens in new tab- Shehabi Y, Howe BD, Bellomo R, et al. Early sedation with dexmedetomidine in critically ill patients. N Engl J Med 2019;380:2506-2517.
Free Full Text
Web of Science. opens in new tab
Medline. opens in new tab
Google Scholar. opens in new tab- Laerkner E, Stroem T, Toft P. No-sedation during mechanical ventilation: impact on patient's consciousness, nursing workload and costs. Nurs Crit Care 2015.
Web of Science. opens in new tab
Medline. opens in new tab
Google Scholar. opens in new tab- Chanques G, Conseil M, Roger C, et al. Immediate interruption of sedation compared with usual sedation care in critically ill postoperative patients (SOS-Ventilation): a randomised, parallel-group clinical trial. Lancet Respir Med 2017;5:795-805.
Crossref. opens in new tab
Web of Science. opens in new tab
Medline. opens in new tab
Google Scholar. opens in new tab
このサイトの監修者
 亀田総合病院
亀田総合病院
集中治療科部長 林 淑朗
【専門分野】
集中治療医学、麻酔科学

