microbiology round
2024年9月5日のMicrobiology Roundは、Staphylococcus lugdunensisを取り上げました。ポイントは下記3点です。
・S. lugdunensisはS. aureusと同様の病原性を持ち、同様の感染症を引き起こすため、血液培養から1セットのみの発育でも基本的には真の菌血症として対応する。
・S. aureus以外のStaphylococcus属を「coagulase-negative staphylococci (CNS)」までしか同定していない施設では、S. lugdunensisが見逃されている可能性がある。
・他のCNSと異なり、メチシリン感受性であることが多い。
【歴史】(1)
・Staphylococcus lugdunensisは、Staphylococcus schleiferiとともに1988年に初めて報告された(2)。「lugdunensis」は、この微生物が最初に分離されたフランスの都市である「Lugdunum(Lyonのラテン語名)」に由来する。
【微生物学的特徴】(3)
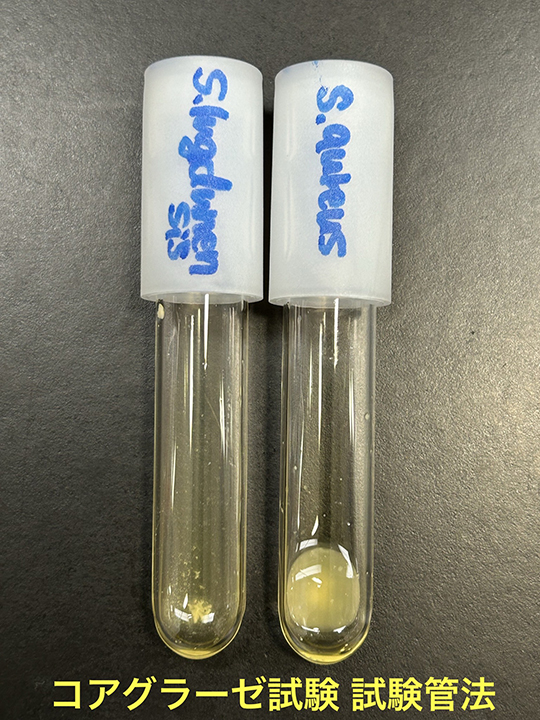
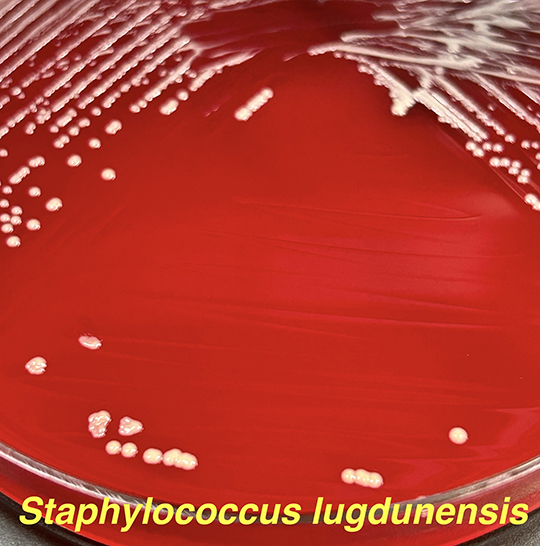
・S. lugdunensisはグラム陽性、非運動性のカタラーゼ陽性の球菌で、直径は0.8~1.0m、単数または対、クラスター状または短い鎖状である(2)。通性嫌気性菌で、30〜45℃の培地でよく発育する。10%または15%の塩化ナトリウムで、それぞれ24時間または96時間培養すると増殖が持続する。コロニーの形態、色素沈着、溶血は株によって異なり、無色やクリーム色、淡黄色から黄金色にみえることがある(2,4)。S. lugdunensisはコアグラーゼ陰性菌であるが、ヒト血漿または市販のラテックス凝集キットを用いたスライド凝集試験で、凝集因子(結合型コアグラーゼ)が陽性となる株が、最大で65.4%の症例で存在するとの報告がある(2,5)。S. lugdunensisはプロテインAを持たない(2,6)。アセトイン産生、硝酸塩還元、オルニチン脱炭酸酵素やpyrrolidonyl arylamidase (PYR)活性は陽性であるが、オキシダーゼやアルカリホスファターゼは陰性である(2,3)。
・市販の表現型解析システム(7)やmatrix-assisted laser desorption ionization–time of flight mass spectrometry (MALDI TOF MS)(8)、標的遺伝子を用いた方法(9)によって同定することができる。MALDI TOF MSを日常的に使用することで、臨床検体中のS. lugdunensisの同定が18倍に増加したとの報告もある(10)。
■病原因子(11)
・S. lugdunensisのゲノム配列を解析したところ、この種にはコアグラーゼ、自然免疫回避タンパク質、プロテインA、β-バレル孔形成細胞溶解毒素、エンテロトキシンなど、S. aureusに特徴的な病原性因子の多くが欠如していることが明らかになった(12,13)。
・S. lugdunensisの病原因子には、S. aureusに類似したaccessory gene regulator system (agr)や溶血ペプチド(hemolytic S. lugdunensis synergistic hemolysins:SLUSH)、peptidoglycan O-acetyltransferase (OatA)、von Willebrand factor binding protein of S. lugdunenesis (vWbl)、the fibrinogen binding protein of S. lugdunensis (Fbl)、polysaccharide poly-N-acetylglucosamine (PNAG) / intercellular adhesin (PIA)などがある(14)。
・オプソニン化による貪食の阻害は、おそらく莢膜の発現によって引き起こされる。分泌されたプロテアーゼはオプソニンの分解を促進するかもしれない。DNaseはneutrophil extracellular traps (NETs)を分解し、抗菌薬による捕捉と殺菌を妨げる可能性がある。細菌のメタロプロテアーゼであるlugdulysinは、おそらくS. aureusのaureolysinと同様にオプソニン分解に寄与している(5)。
・細菌の細胞壁は、N-acetylglucosamine (NAG)とN-Acetylmuramic acid (NAM)がβ‐1,4‐結合したぺプチドグリカンを主成分としており、リゾチームはNAGとNAMのβ-1,4‐結合部に対して作用し、細胞壁の分解を促進する。Staphylococcus属が産生するpeptidoglycan O-acetyltransferase (OatA)は、NAMをアセチル化し、リゾチームとの結合を阻害する(15)。
・polysaccharide poly-N-acetylglucosamine (PNAG) / intercellular adhesin (PIA)はStaphylococcus属(特にS. aureusやS. epidermidis)のバイオフィルムを形成する成分として最もよく知られている(16,17)。S. lugdunenesisでの明確な機序は判明していないが、他のCNSと同様にバイオフィルムを形成し、人工関節感染症(prosthetic joint infection:PJI)の一因となっている可能性が高い。
・血管内感染は、まだ知られていない表面成分(vWblではない)が、炎症内皮細胞上の表面に付着したvon Willebrand factor (vWF)に結合することによって始まっている可能性がある。細菌はin vitroで内皮細胞に侵入することができるので、これが内皮細胞損傷を引き起こしているのかもしれない。細菌は露出した細胞外マトリックスのコラーゲンに結合したvWFに付着する。the fibrinogen binding protein of S. lugdunensis (Fbl)を介してfibrinogen/fibrinと結合する能力は、オプソニンを隠蔽し、損傷した心臓の弁の血栓への付着を促進することによって、血流中の免疫回避に寄与している可能性が高い。
・S. lugdunensisはS. aureusと同様に、iron-regulated surface determinant (Isd)蛋白をコードする遺伝子座を持っており、栄養ヘムの獲得を促進する(18)。赤血球からヘモグロビンを放出させるhemolytic S. lugdunensis synergistic hemolysins (SLUSH)は、β-toxinと相乗的に作用して赤血球を溶解する。
【疫学】
・S. lugdunensisはヒトの皮膚マイクロバイオームの構成菌であり、主に下半身や四肢、特に鼠径部や会陰部、大指の爪の下などの湿潤部位に生息し、人口の66.7%に見られる(19–21)。
・臨床的に分離・同定された494株のcoagulase-negative staphylococci (CNS)のうち、S. lugdunensisは3% (15株)であったとの報告(22)や、S. lugdunensisが分離同定された229株のうち、コンタミネーションや定着と考えられたのは15.4%であった(23)との報告がある。日本における多施設研究で、全ての菌血症2478例のうち0.28%(7例)でS. lugdunensisが同定され、CNS(281例)の中では2.49%であった(24)。CNSの同定を日常的に行わない施設では、S. lugdunensisの感染症が見過ごされている可能性がある。
【臨床的特徴】
・臨床的にはS. aureusと同様の病態を引き起こすため、S. lugdunensisが同定された場合には、通常はコンタミネーションではなく真の起炎菌として扱うべきである。血液培養で1セットのみS. lugdunensisが発育した29例のうち、13例(44.8%)が真の菌血症であったとの報告がある(25)。真の菌血症の場合にも、他のCNSよりも膿瘍などの合併症の発生率が高い(26)。
・主な感染巣は、S. aureusと同様に、皮膚軟部組織感染症、カテーテル関連血流感染症、感染性心内膜炎、骨髄炎、関節炎などである(27)。CNSによる感染性心内膜炎のうち、S. lugdunensis はS. epidermidisに次いで2番目に多かったとの報告もある(28)。
・その他に、眼内炎、脳室腹腔シャント感染、子宮内膜炎、化膿性リンパ節炎、腸腰筋膿瘍、肺膿瘍、尿路感染症、腹膜透析カテーテル感染などが報告されている(14)。
【治療】
・S. lugdunensisは、他のCNSとは異なりβラクタマーゼを産生しない株は約76.2%であったとの報告もある(29)。多くはblaZ遺伝子が陰性で、mecA遺伝子の存在は稀である(30)。In vitroでのペニシリンの耐性率は、15.4〜87%と報告や地域によって差がある(26,31–33)。
・Clinical Laboratory and Standards Institute (CLSI)におけるS. lugdunensisのoxacillinへのbreakpointは、S. aureusと同じに設定されている(34)。
・β-ラクタム系抗菌薬が使用できない場合には、バンコマイシンが代替薬になる(14)。
【参考文献】
1. LPSN - List of Prokaryotic names with Standing in Nomenclature “Staphylococcus lugdunensis” [Internet]. [cited 2024 Sep 10]. Available from: https://lpsn.dsmz.de/species/staphylococcus-lugdunensis
2. Freney J, YBMBHMFGPADGCN and JF. Staphylococcus lugdunensis sp. nov. and Staphylococcus schleiferi sp. nov., two species from human clinical specimens. Int J Syst Bacteriol. 1988;38:168–72.
3. Karsten Becker MZD and RLS. 21. Staphylococcus, Micrococcus, and Other Catalase‐Positive Cocci. In: Karen C. Carroll and Michael A. Pfaller, editor. Manual of Clinical Microbiology, 13th Edition. 2023. p. 392–428.
4. Fleurette J, Bès M, Brun Y, Freney J, Forey F, Coulet M, et al. Clinical isolates of Staphylococcus lugdunensis and S. schleiferi: bacteriological characteristics and susceptibility to antimicrobial agents. Res Microbiol. 1989;140(2):107–18.
5. Argemi X, Prévost G, Riegel P, Keller D, Meyer N, Baldeyrou M, et al. VISLISI trial, a prospective clinical study allowing identification of a new metalloprotease and putative virulence factor from Staphylococcus lugdunensis. Clinical Microbiology and Infection. 2017 May;23(5):334.e1-334.e8.
6. Paulsson M, Petersson AC, Ljungh A. Serum and tissue protein binding and cell surface properties of Staphylococcus lugdunensis. J Med Microbiol. 1993 Feb 1;38(2):96–102.
7. Mateo M, Maestre JR, Aguilar L, Cafini F, Puente P, Sánchez P, et al. Genotypic versus phenotypic characterization, with respect to susceptibility and identification, of 17 clinical isolates of Staphylococcus lugdunensis. Journal of Antimicrobial Chemotherapy. 2005 Aug 1;56(2):287–91.
8. Loonen AJM, Jansz AR, Bergland JNB, Valkenburg M, Wolffs PFG, van den Brule AJC. Comparative Study Using Phenotypic, Genotypic, and Proteomics Methods for Identification of Coagulase-Negative Staphylococci. J Clin Microbiol. 2012 Apr;50(4):1437–9.
9. Petti CA, Simmon KE, Miro JM, Hoen B, Marco F, Chu VH, et al. Genotypic Diversity of Coagulase-Negative Staphylococci Causing Endocarditis: a Global Perspective. J Clin Microbiol. 2008 May;46(5):1780–4.
10. Elamin WF, Ball D, Millar M. Unbiased Species-Level Identification of Clinical Isolates of Coagulase-Negative Staphylococci: Does It Change the Perspective on Staphylococcus lugdunensis? J Clin Microbiol. 2015 Jan;53(1):292–4.
11. Heilbronner S, Foster TJ. Staphylococcus lugdunensis: a Skin Commensal with Invasive Pathogenic Potential. Clin Microbiol Rev. 2021 Mar 17;34(2).
12. Lebeurre J, Dahyot S, Diene S, Paulay A, Aubourg M, Argemi X, et al. Comparative Genome Analysis of Staphylococcus lugdunensis Shows Clonal Complex-Dependent Diversity of the Putative Virulence Factor, ess/Type VII Locus. Front Microbiol. 2019 Oct 31;10.
13. Heilbronner S, Holden MTG, van Tonder A, Geoghegan JA, Foster TJ, Parkhill J, et al. Genome sequence of Staphylococcus lugdunensis N920143 allows identification of putative colonization and virulence factors. FEMS Microbiol Lett. 2011 Sep;322(1):60–7.
14. Frank KL, del Pozo JL, Patel R. From clinical microbiology to infection pathogenesis: how daring to be different works for Staphylococcus lugdunensis. Clin Microbiol Rev. 2008 Jan;21(1):111–33.
15. Bera A, Herbert S, Jakob A, Vollmer W, Götz F. Why are pathogenic staphylococci so lysozyme resistant? The peptidoglycan O‐acetyltransferase OatA is the major determinant for lysozyme resistance of Staphylococcus aureus. Mol Microbiol. 2005 Feb 9;55(3):778–87.
16. Götz F. Staphylococcus and biofilms. Mol Microbiol. 2002 Mar 25;43(6):1367–78.
17. O’Gara JP. ica and beyond: biofilm mechanisms and regulation in Staphylococcus epidermidis and Staphylococcus aureus. FEMS Microbiol Lett. 2007 May;270(2):179–88.
18. Hammer ND, Skaar EP. Molecular mechanisms of Staphylococcus aureus iron acquisition. Annu Rev Microbiol. 2011 Oct 13;65(1):129–47.
19. Ho PL, Leung SMH, Chow KH, Tse CWS, Cheng VCC, Tse H, et al. Carriage niches and molecular epidemiology of Staphylococcus lugdunensis and methicillin-resistant S. lugdunensis among patients undergoing long-term renal replacement therapy. Diagn Microbiol Infect Dis. 2015 Feb;81(2):141–4.
20. Bieber L, Kahlmeter G. Staphylococcus lugdunensis in several niches of the normal skin flora. Clinical Microbiology and Infection. 2010 Apr;16(4):385–8.
21. van der Mee-Marquet N, Achard A, Mereghetti L, Danton A, Minier M, Quentin R. Staphylococcus lugdunensis infections: high frequency of inguinal area carriage. J Clin Microbiol. 2003 Apr;41(4):1404–9.
22. Gatermann SG, Koschinski T, Friedrich S. Distribution and expression of macrolide resistance genes in coagulase-negative staphylococci. Clinical Microbiology and Infection. 2007 Aug;13(8):777–81.
23. Herchline TE, Ayers LW. Occurrence of Staphylococcus lugdunensis in consecutive clinical cultures and relationship of isolation to infection. J Clin Microbiol. 1991 Mar;29(3):419–21.
24. Ainoda Y, Takeshita N, Hase R, Mikawa T, Hosokawa N, Kawamura I, et al. Multicenter Study of the Clinical Presentation of Staphylococcus lugdunensis Bacteremia in Japan. Jpn J Infect Dis. 2017;70(4):405–7.
25. Fadel HJ, Patel R, Vetter EA, Baddour LM. Clinical Significance of a Single Staphylococcus lugdunensis-Positive Blood Culture. J Clin Microbiol. 2011 Apr;49(4):1697–9.
26. Böcher S, Tønning B, Skov RL, Prag J. Staphylococcus lugdunensis , a Common Cause of Skin and Soft Tissue Infections in the Community. J Clin Microbiol. 2009 Apr;47(4):946–50.
27. Parthasarathy S, Shah S, Raja Sager A, Rangan A, Durugu S. Staphylococcus lugdunensis: Review of Epidemiology, Complications, and Treatment. Cureus. 2020 Jun 24;
28. Petti CA, Simmon KE, Miro JM, Hoen B, Marco F, Chu VH, et al. Genotypic Diversity of Coagulase-Negative Staphylococci Causing Endocarditis: a Global Perspective. J Clin Microbiol. 2008 May;46(5):1780–4.
29. Herchline TE, Barnishan J, Ayers LW, Fass RJ. Penicillinase production and in vitro susceptibilities of Staphylococcus lugdunensis. Antimicrob Agents Chemother. 1990 Dec;34(12):2434–5.
30. Teh JSK, Pantelis I, Chen X, Sadlon T, Papanaoum K, Gordon DL. Antimicrobial Susceptibility Testing for Staphylococcus lugdunensis. J Clin Microbiol. 2022 Jan 19;60(1).
31. Hellbacher C, Törnqvist E, Söderquist B. Staphylococcus lugdunensis: clinical spectrum, antibiotic susceptibility, and phenotypic and genotypic patterns of 39 isolates. Clinical Microbiology and Infection. 2006 Jan;12(1):43–9.
32. Yen TY, Sung YJ, Lin HC, Peng CT, Tien N, Hwang KP, et al. Emergence of oxacillin-resistant Staphylococcus lugdunensis carrying staphylococcal cassette chromosome mec type V in central Taiwan. Journal of Microbiology, Immunology and Infection. 2016 Dec;49(6):885–91.
33. Taha L, Stegger M, Söderquist B. Staphylococcus lugdunensis: antimicrobial susceptibility and optimal treatment options. European Journal of Clinical Microbiology & Infectious Diseases. 2019 Aug 29;38(8):1449–55.
34. Clinical and Laboratory Standards Institute. CLSI M100-ED34:2024 Performance Standards for Antimicrobial Susceptibility Testing, 34th Edition.

このサイトの監修者
 亀田総合病院
亀田総合病院
臨床検査科部長、感染症内科部長、地域感染症疫学・予防センター長 細川 直登
【専門分野】
総合内科:内科全般、感染症全般、熱のでる病気、微生物が原因になっておこる病気
感染症内科:微生物が原因となっておこる病気 渡航医学
臨床検査科:臨床検査学、臨床検査室のマネジメント
研修医教育

