microbiology round
2024年5月30日のMicrobiology roundは、Klebsiella(Enterobacter) aerogenesを取り上げました。
ポイントは下記です。
・2017年にKlebsiella属に分類されたが、性質は従来通りEnterobacter属に近く、AmpC過剰産生し易い菌の一つである。
・医療関連感染症が多い。
【歴史】
・”aeros”=「air」、”genes”=「producing (産生する)」
・1929年にEdwardsにより”Aerobacter aerogenes"として認められており(1)、1960年にEnterobacter属に分類された(2)。1971年に表現型の観点からKlebsiella属によく似たEnterobacter aerogenes株の小集団の特徴が明らかになり(3)、当時Klebsiella mobilisという分類名も使用されたが、最終的には2017年にKlebsiella aerogenesに名称が変更となった(4,5)。(※以降は従来通りの「E. aerogenes」で記載)
【微生物学的特徴】
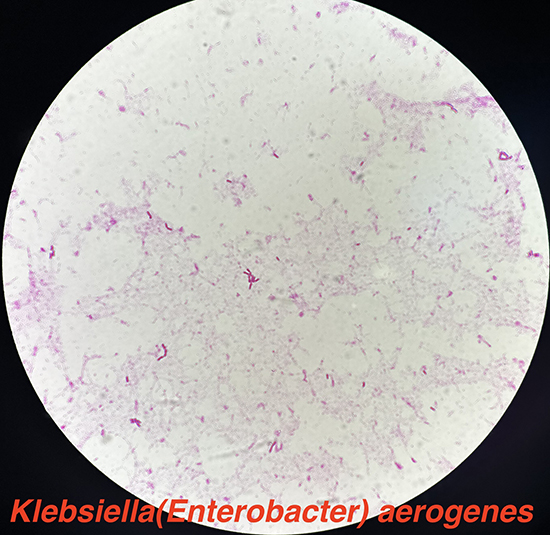
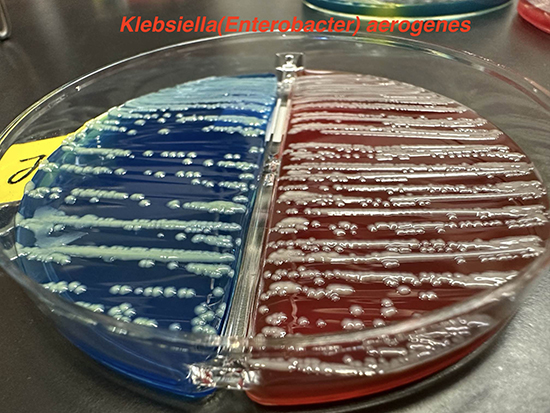
・通性嫌気性グラム陰性桿菌。鞭毛を有し、運動性がある。非芽胞形成。粘液性のコロニーを形成。乳糖を発酵し、オキシダーゼ陰性。インドール-3-ピルビン酸(IPA)陰性、リシンデカルボキシラーゼ陽性(6)。
・Enterobacter属は水や土壌などの自然環境に広く生息しており、特にEnterobacter cloacaeとEnterobacter aerogenesは乳製品や肉、皮膚、ヒトと動物の腸管内にも認める。(7)
・E. aerogenesとE. cloacaeがEnterobacter属による感染症の90~99%を占め、特にICUで人工呼吸器管理を受けている患者や、抗菌薬曝露歴がある患者における医療関連感染症の起因菌として重要である(8–10)。E. cloacaeとE. aerogenesの臨床的な違いはあまり判明していないが、E. cloacaeの方が抗菌薬耐性菌率が高く、E. aerogenes感染症の方が敗血症性ショックが多く予後が悪い傾向にあるとの報告もある(9)。
【臨床的特徴】
・院内発症の肺炎(特に人工呼吸器関連肺炎)、複雑性尿路感染症(多くはカテーテルや医療器具関連)、創部感染、カテーテル関連血流感染症、人工物感染、脳外科術後の髄膜炎などを起こす(6,8–10)。
■抗菌薬耐性の機序(6,10)
・β-ラクタマーゼ産生が主なβラクタム耐性のメカニズムである(11)。
・第一世代セファロスポリンに対する耐性を誘導する、低レベルのAmpC β-ラクタマーゼ型セファロスポリナーゼ(group 1 Bush)を自然に発現している(12)。第3世代セファロスポリン投与中の誘導、またはAmpR抑制因子の変異によって染色体由来AmpCセファロスポリナーゼの過剰産生を誘導し、殆ど全てのβ-ラクタム薬に対する耐性を生成する(13)。さらに、セファロスポリナーゼAmpC遺伝子を保有するE. aerogenes株は、染色体由来の遺伝子(blaCMY-10)を大きなプラスミド(130 kb)上に組み込み、抗菌薬の暴露がない場合でも系統的な遺伝子伝達に寄与していることが報告されている(14)。これらの株では、セフェピムやcefpirome、カルバペネムを除く全てのβ-ラクタム系抗菌薬に耐性となる(13)。
・1993年に、Enterobacter属のextended-spectrum β-lactamase (ESBL)産生株による最初の院内感染症例が報告され(15)、1998年にゲンタマイシンとトリメトプリムに耐性を示すESBL産生株が報告された(16)。様々なESBLがTEM、SHV、CTX-ラクタマーゼに属することが同定されたが、依然としてTEM-24が優先的に結合するプラスミドと関連している(17–19)。通常これらの株では、カルバペネム系抗菌薬の感受性は保たれている。
・Omp35とOmp36のバランスの変化によるporinの発現の変化(20)や、IPM、NDM、KPCタイプのカルバペネマーゼによるカルバペネム耐性株が報告されてきている(11,18,20)。インドではNDM-1型やVIM-2、VIM-6型カルバペネマーゼが報告され(21)、ヨーロッパ・アジアではKPC型のセリンプロテアーゼ群やOXA-48型のカルバペネマーゼ特性を有するクラスDβ-ラクタマーゼが報告されている(22)。pmrAの変異によるコリスチン耐性も報告されている(23)。
【治療】(24)
・誘導性ampC遺伝子によってAmpCを過剰産生しやすい腸内細菌目細菌(Enterobacter cloacae complexやEnterobacter aerogenes、Citrobacter freundiiなど。Enterobacter属では約19%と報告されている)(25,26)による感染症に対しては、第3世代セフェムではなく、セフェピムもしくはカルバペネムでの治療が推奨されている。セフェピムはAmpC誘導作用が弱く、安定したアシル酵素複合体の形成によりAmpCβ-ラクタマーゼによる加水分解に耐えることができる(27,28)ので、一般的なAmpC過剰産生菌による感染症の治療に有効である(29)。AmpC過剰産生菌に対するセフェピムとカルバペネムを直接比較した臨床研究はないが、これまでの観察研究では、予後に差がないと報告されている(30–32)。但し、セフェピムの最小発育阻止濃度(Minimum Inhibitory Concentration:MIC)が4~8μg/mLの場合には、88.9%(32/36人)がESBL共産生していたとの報告もあり (33)、MIC≧4の場合にはセフェムではなくカルバペネムで治療開始することも提案されている(24)。The Clinical and Laboratory Standards Institute (CLSI)のCLSI M100-ED34:2024 Performance Standards for Antimicrobial Susceptibility Testing, 34th Editionでは、腸内細菌目細菌へのセフェピムのMIC:4~8は、「susceptible-dose dependent (SDD)」と定義されている。
・第3世代セフェムは、特にE. cloacae complexやE. aerogenes、C. freundii でAmpC過剰産生を誘導しやすいが、第3世代セフェム投与中のどのタイミングで耐性化するかの明確なデータはない。Enterobacter属やSerratia属、Citrobacter属による菌血症に対する第3世代セフェムによる治療で、死亡率に差がなかったとの観察研究もある(34)ことなどから、非複雑性膀胱炎の治療における第3世代セフェムの使用は妥当とされている(24)。
・非β-ラクタム系抗菌薬(ST合剤やフルオロキノロン、アミノグリコシドやテトラサイクリン)はampCを誘導せず、またAmpC加水分解の基質にもならない(24)。フルオロキノロンに対する耐性は、標的の改変か他の種によって伝達されるプラスミド介在性耐性(efluxポンプをコードするqnrSまたはqepA)によるものである(6)。
【引用文献】
1. Edwards PR. RELATIONSHIPS OF THE ENCAPSULATED BACILLI WITH SPECIAL REFERENCE TO BACT. AEROGENES. J Bacteriol. 1929 May;17(5):339–53.
2. Hormaeche E EP. A proposed genus Enterobacter. Int Bull Bacteriol Nomen Taxon. 1960;10:71–4.
3. Bascomb S, Lapage SP, Willcox WR, Curtis MA. Numerical classification of the tribe Klebsielleae. J Gen Microbiol. 1971 Jun;66(3):279–95.
4. Tindall BJ, Sutton G, Garrity GM. Enterobacter aerogenes Hormaeche and Edwards 1960 (Approved Lists 1980) and Klebsiella mobilis Bascomb et al. 1971 (Approved Lists 1980) share the same nomenclatural type (ATCC 13048) on the Approved Lists and are homotypic synonyms, with consequences for the name Klebsiella mobilis Bascomb et al. 1971 (Approved Lists 1980). Int J Syst Evol Microbiol. 2017 Feb;67(2):502–4.
5. Munson E, Carroll KC. An Update on the Novel Genera and Species and Revised Taxonomic Status of Bacterial Organisms Described in 2016 and 2017. J Clin Microbiol. 2019 Feb;57(2).
6. Davin-Regli A, Lavigne JP, Pagès JM. Enterobacter spp.: Update on Taxonomy, Clinical Aspects, and Emerging Antimicrobial Resistance. Clin Microbiol Rev. 2019 Sep 18;32(4).
7. Karen C. Carroll and Michael A. Pfaller, editor. Manual of Clinical Microbiology. 13th ed. Vol. 2. 2023. 792–816 p.
8. Lockhart SR, Abramson MA, Beekmann SE, Gallagher G, Riedel S, Diekema DJ, et al. Antimicrobial resistance among Gram-negative bacilli causing infections in intensive care unit patients in the United States between 1993 and 2004. J Clin Microbiol. 2007 Oct;45(10):3352–9.
9. Song EH, Park KH, Jang EY, Lee EJ, Chong YP, Cho OH, et al. Comparison of the clinical and microbiologic characteristics of patients with Enterobacter cloacae and Enterobacter aerogenes bacteremia: a prospective observation study. Diagn Microbiol Infect Dis. 2010 Apr;66(4):436–40.
10. Davin-Regli A, Pagès JM. Enterobacter aerogenes and Enterobacter cloacae; versatile bacterial pathogens confronting antibiotic treatment. Front Microbiol. 2015;6:392.
11. Miró E, Alonso C, Navarro F, Mirelis B, Prats G. [Resistance to imipenem in Enterobacter aerogenes]. Enferm Infecc Microbiol Clin. 1995 May;13(5):278–82.
12. Freney J, Husson MO, Gavini F, Madier S, Martra A, Izard D, et al. Susceptibilities to antibiotics and antiseptics of new species of the family Enterobacteriaceae. Antimicrob Agents Chemother. 1988 Jun;32(6):873–6.
13. Preston KE, Radomski CC, Venezia RA. Nucleotide sequence of the chromosomal ampC gene of Enterobacter aerogenes. Antimicrob Agents Chemother. 2000 Nov;44(11):3158–62.
14. Lee SH, Jeong SH, Park YM. Characterization of blaCMY-10 a novel, plasmid-encoded AmpC-type beta-lactamase gene in a clinical isolate of Enterobacter aerogenes. J Appl Microbiol. 2003;95(4):744–52.
15. Goldstein FW, Péan Y, Rosato A, Gertner J, Gutmann L. Characterization of ceftriaxone-resistant Enterobacteriaceae: a multicentre study in 26 French hospitals. Vigil’Roc Study Group. J Antimicrob Chemother. 1993 Oct;32(4):595–603.
16. Pitout JD, Thomson KS, Hanson ND, Ehrhardt AF, Coudron P, Sanders CC. Plasmid-mediated resistance to expanded-spectrum cephalosporins among Enterobacter aerogenes strains. Antimicrob Agents Chemother. 1998 Mar;42(3):596–600.
17. Neuwirth C, Siebor E, Lopez J, Pechinot A, Kazmierczak A. Outbreak of TEM-24-producing Enterobacter aerogenes in an intensive care unit and dissemination of the extended-spectrum beta-lactamase to other members of the family enterobacteriaceae. J Clin Microbiol. 1996 Jan;34(1):76–9.
18. Biendo M, Canarelli B, Thomas D, Rousseau F, Hamdad F, Adjide C, et al. Successive emergence of extended-spectrum beta-lactamase-producing and carbapenemase-producing Enterobacter aerogenes isolates in a university hospital. J Clin Microbiol. 2008 Mar;46(3):1037–44.
19. Kanamori H, Yano H, Hirakata Y, Hirotani A, Arai K, Endo S, et al. Molecular characteristics of extended-spectrum beta-lactamases and qnr determinants in Enterobacter species from Japan. PLoS One. 2012;7(6):e37967.
20. Lavigne JP, Sotto A, Nicolas-Chanoine MH, Bouziges N, Bourg G, Davin-Regli A, et al. Membrane permeability, a pivotal function involved in antibiotic resistance and virulence in Enterobacter aerogenes clinical isolates. Clin Microbiol Infect. 2012 Jun;18(6):539–45.
21. Khajuria A, Praharaj AK, Kumar M, Grover N. Carbapenem Resistance among Enterobacter Species in a Tertiary Care Hospital in Central India. Chemother Res Pract. 2014;2014:972646.
22. Torres E, López-Cerero L, Del Toro MD, Pascual A. First detection and characterization of an OXA-48-producing Enterobacter aerogenes isolate. Enferm Infecc Microbiol Clin. 2014;32(7):469–70.
23. Diene SM, Merhej V, Henry M, El Filali A, Roux V, Robert C, et al. The rhizome of the multidrug-resistant Enterobacter aerogenes genome reveals how new “killer bugs” are created because of a sympatric lifestyle. Mol Biol Evol. 2013 Feb;30(2):369–83.
24. Tamma PD, Aitken SL, Bonomo RA, Mathers AJ, van Duin D, Clancy CJ. Infectious Diseases Society of America 2023 Guidance on the Treatment of Antimicrobial Resistant Gram-Negative Infections. Clin Infect Dis. 2023 Jul 18;
25. Kohlmann R, Bähr T, Gatermann SG. Species-specific mutation rates for ampC derepression in Enterobacterales with chromosomally encoded inducible AmpC β-lactamase. J Antimicrob Chemother. 2018 Jun 1;73(6):1530–6.
26. Chow JW, Fine MJ, Shlaes DM, Quinn JP, Hooper DC, Johnson MP, et al. Enterobacter bacteremia: clinical features and emergence of antibiotic resistance during therapy. Ann Intern Med. 1991 Oct 15;115(8):585–90.
27. Hancock RE, Bellido F. Antibacterial in vitro activity of fourth generation cephalosporins. J Chemother. 1996 Feb;8 Suppl 2:31–6.
28. Negri MC, Baquero F. In vitro selective concentrations of cefepime and ceftazidime for AmpC beta-lactamase hyperproducer Enterobacter cloacae variants. Clin Microbiol Infect. 1999 Mar;5 Suppl 1:S25–8.
29. Harris PNA, Wei JY, Shen AW, Abdile AA, Paynter S, Huxley RR, et al. Carbapenems versus alternative antibiotics for the treatment of bloodstream infections caused by Enterobacter, Citrobacter or Serratia species: a systematic review with meta-analysis. J Antimicrob Chemother. 2016 Feb;71(2):296–306.
30. Tamma PD, Girdwood SCT, Gopaul R, Tekle T, Roberts AA, Harris AD, et al. The use of cefepime for treating AmpC β-lactamase-producing Enterobacteriaceae. Clin Infect Dis. 2013 Sep;57(6):781–8.
31. Siedner MJ, Galar A, Guzmán-Suarez BB, Kubiak DW, Baghdady N, Ferraro MJ, et al. Cefepime vs other antibacterial agents for the treatment of Enterobacter species bacteremia. Clin Infect Dis. 2014 Jun;58(11):1554–63.
32. Tan SH, Ng TM, Chew KL, Yong J, Wu JE, Yap MY, et al. Outcomes of treating AmpC-producing Enterobacterales bacteraemia with carbapenems vs. non-carbapenems. Int J Antimicrob Agents. 2020 Feb;55(2):105860.
33. Lee NY, Lee CC, Li CW, Li MC, Chen PL, Chang CM, et al. Cefepime Therapy for Monomicrobial Enterobacter cloacae Bacteremia: Unfavorable Outcomes in Patients Infected by Cefepime-Susceptible Dose-Dependent Isolates. Antimicrob Agents Chemother. 2015 Dec;59(12):7558–63.
34. Derrick C, Bookstaver PB, Lu ZK, Bland CM, King ST, Stover KR, et al. Multicenter, Observational Cohort Study Evaluating Third-Generation Cephalosporin Therapy for Bloodstream Infections Secondary to Enterobacter, Serratia, and Citrobacter Species. Antibiotics (Basel). 2020 May 14;9(5).
このサイトの監修者
 亀田総合病院
亀田総合病院
臨床検査科部長、感染症内科部長、地域感染症疫学・予防センター長 細川 直登
【専門分野】
総合内科:内科全般、感染症全般、熱のでる病気、微生物が原因になっておこる病気
感染症内科:微生物が原因となっておこる病気 渡航医学
臨床検査科:臨床検査学、臨床検査室のマネジメント
研修医教育

