MELIt
 【論文】Nishikimi M, Numaguchi A, et al. Effect of Administration of Ramelteon, a Melatonin Receptor Agonist, on the Duration of Stay in the ICU: A Single-Center Randomized Placebo-Controlled Trial. Crit Care Med. 2018 Mar 27. doi:1 0.1097/CCM.0000000000003132. PMID: 29595562.
【論文】Nishikimi M, Numaguchi A, et al. Effect of Administration of Ramelteon, a Melatonin Receptor Agonist, on the Duration of Stay in the ICU: A Single-Center Randomized Placebo-Controlled Trial. Crit Care Med. 2018 Mar 27. doi:1 0.1097/CCM.0000000000003132. PMID: 29595562.
【Reviewer】Ryohey Yamamoto
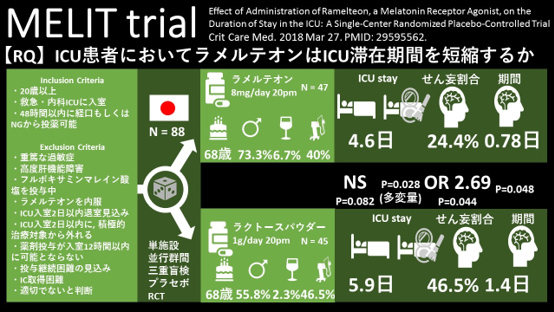
【Research Question】ICU患者においてラメルテオンはせん妄発症を抑制しICU滞在期間を短縮するか
【Visual Abstract】
【わかっていること】
- メラトニンは松果体から分泌される内分泌物質である
- 抗酸化作用、抗炎症作用、サーカディアンリズム調節などの作用がある
- ICU患者ではメラトニン分泌が抑制されている 2-4
- ICU患者ではメラトニンによりせん妄が抑制されるかもしれない
- せん妄はICU患者のICU期間延長、高い死亡割合、人工呼吸の延長、ICU・入院コストの増加などの負のアウトカムと関連する 9-14
- RCTではメラトニンによりせん妄が抑制される可能性が示唆されている 15-17
【わかっていないこと】
- メラトニン投与により重症患者のアウトカムを改善するかはわかっていない 5.6
- 予防的に投与することの効果は不明
【仮説/目的】ICU患者に対して予防的にメラトニンを投与することでICU滞在期間を短縮しアウトカムを改善する。
【PICO】
P:ICU入室48時間で経口もしくはNGから投薬可能な集中治療患者
Inclusion Criteria: 20歳以上、救急・内科ICUに入室、
Exclusion Criteria:
- ラメルテオンの投与に関する禁忌に相当するもの、すなわち
・ラメルテオンに対して重篤な過敏症のあるもの。
・高度な肝機能障害のあるもの。
・フルボキサミンマレイン酸塩を投与中のもの。 - ラメルテオンの効果の有意性を明確にするため、
・ICU入室以前よりラメルテオンを内服しているもの。
・ICU入室後2日以内の退室が予め見込まれるもの。
・ICU入室後2日以内に、積極的な治療の対象から外れるもの。
・薬剤の投与が、入室12時間以内に可能とならないもの。
・経過中の投与継続が困難と見込まれるもの。 - 本人もしくは代諾者による、 書面上のインフォームド・コンセントが得られないもの。
- その他、本研究の対象として適切でないと判断されたもの。
I:ラメルテオン8mg/day 20時
C:ラクトースパウダー1g/day 20時
O:ICU滞在期間
【期間】日本 名古屋大学附属病院(内科・救急ICU)
【場所】2015年5月〜2017年4月
【デザイン】単施設、並行群間、三重盲検、プラセボ対照群RCT
- 事前プロトコルの有無:UMIN000016541 登録はあるがプロトコル出版はない
- ランダム化の方法:組入前に部外者がランダム化、ランダム化の方法は記載されていない。層別化(60歳、APACHE、人工呼吸の有無)、ブロックランダム化(サイズ4)を使用
- 隠蔽化の有無:未記載(おそらくされていない)
- マスキングの有無と対象者:患者、評価者(tester)、統計家(介入者は薬剤形から気づいたかもしれない)
- IRB:承認あり
- 資金提供:なし
【N】88
【介入】ラメルテオン8mg/day 20時
【対象】ラクトースパウダー1g/day 20時
<両群共通>
- 看護師はマスキングされているためケアに違いは生じない
- 患者家族の面会は11時〜12時と15〜16時の2回/day
- 22時以降は明るさと騒音は最小限に減らす
- RASSは4時間毎測定
- せん妄治療はリスペリドン1mg、DEX持続静注、ハロペリドール5mg
【主要評価項目】ICU滞在期間
入退室条件は多職種カンファ(2回/day)で決定
退室条件:鎮静薬が必要ないか最小限、FiO20.5未満でSpO2≧90%、人工呼吸なし(気管切開後は除く)、昇圧剤がないか最小限、尿量は0.5ml/kg/hrを超える。気管切開されていない人工呼吸患者とCRRT患者は退室しない。
【副次評価項目】
- せん妄発症割合
- せん妄期間
- せん妄はCAM-ICUで定義。4時間毎に測定
【解析】
- サンプルサイズ計算:自施設データに基づき、プラセボ群の平均ICU滞在を4.17日(65.28hr)、標準偏差1.09日として検出力80%、両群検定で0.05とすると各群91人と算出。過去の自施設データでは1ヶ月で26/50人が組み入れられると考えられたため、1年の研究期間(2015/5-2016/5)とした。しかし達成できなかったため2017/4まで延長した。
- ITTの有無:厳密なITTではない。FAS
- 主要解析:ログ変換した日数に対してStudent t test。Baselineのばらつきを考慮し多重線形回帰解析(年齢・APACHE、相関の有無、認知症の有無、RASSの平均点)も追加
【結果】
- フローダイアグラムの解釈(フォローアップ、除外):98人がスクリーニングを受け、6人が拒否。92人がランダム化された。4人が介入前にICU退室し、88人(451 vs 43)で解析した。脱落は0。ICU全体の入室が2年間で98人のはずがないのでフローダイアグラムは入室から記載する必要があった。
- 集団特性(内的妥当性・外的妥当性)
内的:ラメルテオン群で男性(73.3% vs 55.8%)、認知症(13.3% vs 2.3%)、アルコール多飲(6.7% 2.3%)、治療歴が多い
外的:68歳程度で、男性33% vs 24%、APACHE24点、SOFA8点、人工呼吸は40〜46%、 - アドヒアランス:記載が無く不明
- 主要評価項目:
・ICU滞在期間:4.56 days (2.10-7.07 d) vs 5.86 days (2.97-14.16 d)p = 0.082
・事前設定した5つの因子で線形回帰解析 (age, APACHE II score, intubation status (intubated/not intubated), presence/absence of dementia before admission, and the mean, RASS score during the ICU stay)ではp = 0.028であった。 - 副次評価項目
・せん妄割合:24.4% (11/45) vs 46.5% (20/43) (p = 0.044; odds ratio, 2.69 [1.09-6.65]).
・せん妄期間:0.78 vs 1.40 d; p = 0.048
・ICU死亡:6.7% (3/45) vs 7.5% (3/43)
・その他:
・夜間覚醒時間が少ない:0.80 times per night vs 1.31 times per night; p = 0.045
・覚醒しないで眠れた:51% vs 30%; p = 0.048
・睡眠時間:7.29 vs 6.78 hr; p = 0.252
【Strength・Limitation】
- Strength
・はじめてのラメルテオンで臨床アウトカムの改善を報告 - Limitation
・単施設で小規模研究のため一般kが難しい
・サンプル数不足
・不活動型・活動型・金剛型とせん妄を分類しては評価されていない
・ハロペリドール5mgが標準治療よりも量が多い
・患者家族の訪室が制限された
【論文の結論】
ラメルテオンはICU滞在日数を減らす経口があり、せん妄割合をへらす
- 飛躍していないか
・飛躍していない。
【批判的吟味】
<内的妥当性>
- ランダム化の方法が不明。「施設外でランダム表を作成」とあるがそれがどう作られ運用されたのかわからない
- このため隠蔽化されていたか不明。おそらくできていないと思われる。
- マスキングは患者・評価者・統計家と記載されているが8mgの錠剤と1gのラクトースは粉砕しているとはいえ剤形や重さから識別できる可能性がありパフォーマンスバイアスを生む
- フローダイアグラムが98人から始まっているが2年間のスクリーニングとしては少なく選択バイアスの可能性がある
- 主要評価項目がICU滞在期間というソフトエンドポイントであるが、退室条件を規定(それでも決定はカンファなのでアドヒアランスを見る必要がある)
- ベースラインが揃っておらず、ランダム化できていない可能性がある
- 多重線形回帰分析は事前に設定されたとあるがプロトコルの出版がないためわからない
- 5つの因子を組み込んでおり、過剰適合している可能性がある
- 多重線形回帰分析での多重共線性があるかVIFを報告すべきであった
- 感度解析で年齢上昇がICU滞在期間を減らす方向に働いており多重共線性がある可能性が高い
- 感度解析では人工呼吸の有無に影響をうけており、人工呼吸の多いプラセボ群で不利になる
- サンプル数不足によるβエラーの可能性がある
<外的妥当性>
- 単施設、小規模サンプルであり一般化可能性が低い
- 同じ日本人を対象にしている。
- APACHEの割に死亡が少なく、スコアリングに救急外来のデータを用いている可能性がありどのくらいの重症度になるかはわからない
【Implication】
主要評価項目であるICU滞在期間は4.56 days (2.10-7.07 d) vs 5.86 days (2.97-14.16 d)p = 0.082と有意差はなかったが、多重線形回帰分析では有意差を認めた(P=0.028)。副次評価項目のせん妄発症割合は24.4% (11/45) vs 46.5% (20/43) (p = 0.044; odds ratio, 2.69 [1.09-6.65])、せん妄期間は0.78 vs 1.40 d; p = 0.048、ICU死亡は6.7% (3/45)vs 7.5%(3/43)であった。
この研究ではランダム表の生成方法と運用方法が不明、隠蔽化が未記載、マスキングが確実に行われたか不明、2年間で98人しかスクリーニングされず選択バイアスの可能性、ソフトエンドポイン、群間差が大きくランダム化に失敗している可能性などrisk of biasが高い。主要評価の解析もVIFの報告がなく、過剰適合している可能性があり、結果の信頼性は低いと解釈した。
この研究では主要項目の結果はnegativeであったが、メラトニン分泌低下患者へのメラトニンの補充というコンセプトは有望な仮説だと考えている。現在主要評価項目をせん妄発症割合とした、メラトニンによるせん妄の予防効果を検証する多施設二重盲検プラセボ対照群RCTであるPro-MEDIC研究が進行中で、2019/3月に終了予定である。この結果をみて、ICU患者へのメラトニン製剤の使用の判断をするつもりである。
ROB評価をしつこく行ったが、この研究はpilot研究的位置づけの研究であり、そもそも多くの突っ込みをすること事態にはあまり意義はないかもしれない。むしろ、RCTのしづらい日本においてこのような研究が行われたことに個人的には感銘を受けた。昨年のDESIRE研究に引き続き、日本人研究者からのRCTの報告は若手研究者のモチベーションを上げる材料であり、研究者らには賞賛を送りたい。主要評価項目であるICU滞在期間は4.56 days (2.10-7.07 d) vs 5.86 days (2.97-14.16 d)p = 0.082と有意差はなかったが、多重線形回帰分析では有意差を認めた(P=0.028)。副次評価項目のせん妄発症割合は24.4% (11/45) vs 46.5% (20/43) (p = 0.044; odds ratio, 2.69 [1.09-6.65])、せん妄期間は0.78 vs 1.40 d; p = 0.048、ICU死亡は6.7% (3/45)vs 7.5%(3/43)であった。
この研究ではランダム表の生成方法と運用方法が不明、隠蔽化が未記載、マスキングが確実に行われたか不明、2年間で98人しかスクリーニングされず選択バイアスの可能性、ソフトエンドポインであること、群間差が大きくランダム化に失敗している可能性などrisk of biasが高い。主要評価の解析も過剰適合性、多重共線性の問題がありそうで結果の信頼性は低いと解釈した。過剰適合性の対処としてモデルに組み込む因子を減らし、VIFを報告した上で結論を出したほうが良いと考える。また不十分なマスキングとソフトエンドポイントではRCTといえど結果の信頼性が低い。せっかくのRCTなのでマスキングの評価(マスキングのモニタリング、剤形や重さの統一、どの時点で粉砕するかなど)と実際の退室状況を記述すべきであると思う。
この研究では主要項目の結果はnegativeであったが、メラトニン分泌低下患者へのメラトニンの補充というコンセプトは有望な仮説だと考えている。現在主要評価項目をせん妄発症割合とした、メラトニンによるせん妄の予防効果を検証する多施設二重盲検プラセボ対照群RCTであるPro-MEDIC研究が進行中で、2019/3月に終了予定である。この結果をみて、ICU患者へのメラトニン製剤の使用の判断をするつもりである。
ROB評価をしつこく行ったが、この研究はpilot研究的位置づけの研究であり、そもそも多くの突っ込みをすること事態にはあまり意義はないかもしれない。むしろ、RCTのしづらい日本においてこのような研究が行われたことに個人的には感銘を受けた。昨年のDESIRE研究に引き続き、日本人研究者からのRCTの報告は若手研究者のモチベーションを上げる材料であり、研究者らには賞賛を送りたい。
【もっとひといき】
・MELItを動画で見てみる!
・Pro-MEDIC
・ホワイトおじさんから一言
#1 多変量解析における過剰適合性
多変量解析を行う時に、多すぎる説明変数をモデルに投入すると、その標本集団はうまく説明できても(ぴったり適合しても)、母集団を説明することからむしろ離れていくことがあります。例えば、50のアウトカムの生じた200人の集団に、Yes/Noの名義変数を10投入して解析を行おうとすると、その名義変数が取りうる場合の数は2^10 = 1024にも上ります。200人の集団に全て個別の番号を振ることも可能なモデル化になってしまうのです。そのようなモデル化は、ある特定の集団では物凄く良く適合するローカルルールを作っても一般化可能性・再現性が低くなるのです。
#2 多変量解析における多重共線性
多重共線性とは、説明変数相互に強い相関があることです。そもそも説明変数は独立変数と言われることからもわかるように、互いに独立であることが要件のひとつです。例えば、説明変数に体重とBMIを投入すると、この2つの組み合わせは強い共線性があります。こういう共線性の高い組み合わせがモデルの中にあると、推定値が不安定になります。不安定というのは、あるときはBMIが転帰と極端な相関をして、逆に体重が負の相関をするような、理論的には考えにくい相関を生じるようになるのです。この研究での重回帰分析で、年齢や認知症という在室日数を延長させうる説明変数が、実際には短縮させていたことを確認してみて下さい。この相関は変ですね。
多重共線性の評価にはVIF (variance inflation factor) を用いるのが一般的ですが、この研究では評価されていませんでした。
【引用】
- Brzezinski A: Melatonin in humans. N Engl J Med 1997; 336: 186-195
- Olofsson K, Alling C, Lundberg D, et al: Abolished circadian rhythm of melatonin secretion in sedated and artificially ventilated intensive care patients. Acta Anaesthesiol Scand 2004; 48:679-684
- Miyazaki T, Kuwano H, Kato H, et al: Correlation between serum melatonin circadian rhythm and intensive care unit psychosis after thoracic esophagectomy. Surgery 2003; 133:662-668
- Shilo L, Dagan Y, Smorjik Y, et al: Patients in the intensive care unit suffer from severe lack of sleep associated with loss of normal melatonin secretion pattern. Am J Med Sci 1999; 317:278-281
- Bourne RS, Mills GH, Minelli C: Melatonin therapy to improve nocturnal sleep in critically ill patients: Encouraging results from a small randomised controlled trial. Crit Care 2008; 12:R52
- Mistraletti G, Umbrello M, Sabbatini G, et al: Melatonin reduces the need for sedation in ICU patients: A randomized controlled trial. Minerva Anestesiol 2015; 81:1298-1310
- Walker CK, Gales MA: Melatonin receptor agonists for delirium prevention. Ann Pharmacother 2017; 51:72-78
- Tsuda A, Nishimura K, Naganawa E, et al: Ramelteon for the treatment of delirium in elderly patients: A consecutive case series study. Int J Psychiatry Med 2014; 47:97-104
- Inouye SK: Delirium in older persons. N Engl J Med 2006; 354: 1157-1165
- Ely EW, Gautam S, Margolin R, et al: The impact of delirium in the intensive care unit on hospital length of stay. Intensive Care Med 2001; 27:1892-1900
- Barr J, Fraser GL, Puntillo K, et al; American College of Critical Care Medicine: Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit. Crit Care Med 2013; 41:263-306
- Shehabi Y, Riker RR, Bokesch PM, et al; SEDCOM (Safety and Efficacy of Dexmedetomidine Compared With Midazolam) Study Group: Delirium duration and mortality in lightly sedated, mechanically ventilated intensive care patients. Crit Care Med 2010; 38:2311-2318
- Pisani MA, Kong SY, Kasl SV, et al: Days of delirium are associated with 1-year mortality in an older intensive care unit population. Am J Respir Crit Care Med 2009; 180:1092-1097
- Milbrandt EB, Deppen S, Harrison PL, et al: Costs associated with delirium in mechanically
【参考】Appendix
Supplemental Table 1. Multivariate Analysis of a Primary Endpoint Using All Variables
Variable | b coefficient (SE) | t statistic | P value |
|---|---|---|---|
| Ramelteon (vs. Placebo) | -0.380 (0.169) | -2.24 | 0.028 |
| Sex, Male (vs. Female) | 0.145 (0.182) | 0.79 | 0.430 |
| Age, ≧ 60 (vs. < 60) | -0.180 (0.189) | -0.95 | 0.343 |
| APACHE II score, < 30 (vs. ≧ 30) | -0.213 (0.203) | -1.05 | 0.299 |
| Mechanical Ventilation | 0.694 (0.253) | 2.75 | 0.008 |
| Dementia | 0.553 (0.333) | 1.66 | 0.101 |
| Habitual heavy use of alcohol | 0.049 (0.401) | 0.12 | 0.902 |
| Habitual use of a sleeping drug | -0.291 (0.254) | -1.15 | 0.256 |
| Habitual use of a psychiatric medication | -0.218 (0.507) | -0.43 | 0.669 |
| Mean of RASS during the ICU stay | -0.248 (0.101) | -2.46 | 0.016 |
| Admission diagnosis (vs. HF/MI) RF |
0.300 (0.270) | 1.11 | 0.269 |
| Sepsis | 0.199 (0.255) | 0.78 | 0.437 |
| Other | -0.323 (0.231) | -1.39 | 0.167 |
The multivariate analysis was used for variables. Vs. in the table means the reference value.
SE = standard error, APACHE II score = Acute Physiology and Chronic Health Evaluation II score, RASS = Richmond Agitation- Sedation Scale, ICU = Intensive Care Unit, HF = heart failure, MI = myocardial infarction, RF = respiratory failure.
Supplemental Table 2. Analysis of Sleep Parameter of Non-intubated Patients
Variable | Ramelteon Group (n = 27) | Control Group (n = 23) | P value (Univariate) | P value* (Multivariate) |
|---|---|---|---|---|
| Number of awakenings per night, times (SD) | 0.80 (0.87) | 1.31 (0.87) | 0.045 | 0.036 |
| The proportion of nights with no awakening, mean (SD) | 0.51 (0.41) | 0.30 (0.31) | 0.048 | 0.019 |
| Mean sleep duration, hours (SD) | 7.29 (1.67) | 6.78 (1.38) | 0.252 | 0.123 |
*Multivariate analysis was performed by using the same prespecified factors with those used in the analysis of primary endpoint except the variable of intubation status; age, APACHE II score, presence/absence of dementia before admission, and the mean RASS score during the ICU stay.
このサイトの監修者
 亀田総合病院
亀田総合病院
集中治療科部長 林 淑朗
【専門分野】
集中治療医学、麻酔科学

