Tocilizumab for COVID-19: a review at 1, May
COVID-19に対するトシリマブ使用のレビュー

Reviewer:Ryohei Yamamoto
Date:2020/05/01
Summary
COVID 19感染症の患者では、急速に呼吸不全へと進行する重症肺炎を経験する。このような例では、サイトカインストームが急速な疾患進行を導く重要な因子であることがわかっている。しかしながらCOVID-19とそれが引き起こすサイトカインストームに特異的な薬剤は今の所ない。IL-6は、感染症誘発性サイトカインストームに関与する重要なサイトカインの一つである。IL-6受容体拮抗薬であるトシリズマブは、COVID-19に起因するサイトカインストームの治療薬として期待されており、現在多数の臨床試験が行われている。中国、イタリア、フランス、スペイン、ブラジルでは臨床試験の結果以前に使用が行われている。さらに中国、イタリアでは重症COVID-19患者の免疫療法薬として推奨されている。しかしながらCOVID-19に対するトシリズマブの使用を推奨する確信性の高いエビデンスはない。一般的な適応外使用は推奨されないが、もしトシリズマブを使用する場合にはこれまでのエビデンスから、重篤な感染症、好中球減少症、血小板減少症、肝障害のある患者には慎重に使用する必要がある。
Introduction
2019年12月末に中国武漢市で急性呼吸器症候群コロナウイルス2(severe acute respiratory syndrome coronavirus 2 : SARS-CoV-2)を原因微生物とするコロナウイルス疾患2019(coronavirus disease 2019: COVID-19)による新型肺炎が報告され、世界中で感染が拡大している(1)。2020年1月30日に世界保健機関(WHO)は世界的なCOVID-19アウトブレイクを国際的に懸念される公衆衛生上の緊急事態と宣言し(2))、3月12日にはパンデミックの宣言をだし、全世界を巻き込んだ危機となっている(3)。
重度のCOVID 19感染症の患者は、急速に呼吸不全へと進行する肺炎のパターンを経験する。87.9%の患者が発熱し、15.7%の患者で重症肺炎となると言われている(1)。COVID-19が重症化すると、患者は重度のサイトカインストーム、急性呼吸窮迫症候群(ARDS)を発症し、ショック、組織灌流障害、さらには多臓器不全に至ることがある。
サイトカインストームはCOVID-19の急速な進行に重要な因子と考えられている。したがって、サイトカインストームの治療は重症患者を救命する上で重要な役割を果たす可能性がある。しかしながらCOVID-19によるサイトカインストームに特異的薬剤は存在しない。
IL-6受容体拮抗薬であるトシリズマブは、サイトカイン放出症候群(CRS)の治療薬として米国FDAから承認されている。IL-6は感染症誘発性サイトカインストームに関与する重要なサイトカインの一つであることから、COVID-19によるサイトカインストームをトシリズマブで治療できることが期待されている。
中国の治療マニュアルである "Diagnosis and Treatment Plan of Novel Coronavirus Pneumonia (7th trial edition) "では、トシリズマブを重症患者の免疫療法薬として推奨している(4)。しかし、COVID-19の治療におけるトシリズマブの臨床経験やデータは限られている。
COVID-19におけるサイトカイン
サイトカインは、細胞から分泌され、主に細胞間のシグナル伝達やコミュニケーションに利用される小タンパク質群であり、自然免疫、適応免疫、造血、細胞の増殖・分化の調節、受容体に結合して損傷した組織の修復など、様々な生物学的機能を持っている(5)。サイトカインには主にインターロイキン(IL)、インターフェロン(IFN)、腫瘍壊死因子(TNF)、コロニー刺激因子(CSF)、ケモカイン、成長因子などがある。人体が細菌やウイルスに侵されると、免疫系は大量のサイトカインを放出する。COVID-19のアウトブレイクでは、感染者の中には後期に急速に悪化し、最終的には多臓器不全で死亡する患者もおり、その悪化は主にサイトカインストームに起因するのではないかと考えられている(6)。
COVID-19におけるサイトカインストームの生理学的機序
サイトカインストームとは、外部刺激に反応して体内で生成される一種の過剰免疫現象である。サイトカインの制御不能な放出が全身の炎症を引き起こすと考えられている。1993年にFerraraらは、移植片対宿主病におけるサイトカインストームの概念を初めて提唱した(7)。その後、新型インフルエンザでもサイトカインストームが起きることが報告されている(8)。サイトカインストームまたはサイトカイン分泌症候群(CRS: Cytokine releasing syndrome)では難治性低血圧や心機能障害、呼吸不全、凝固障害、腎不全、肝不全などの生命を脅かす臓器障害を伴う。CRSは、リンパ球、マクロファージ、または骨髄系細胞の高度な免疫活性化と、それに続く炎症性サイトカインの大量放出が原因で起こる。血液腫瘍の治療の一つであるCAR-TでもCRSが起こり、IL-6の著しい上昇が起きることがわかっている。(9)。
SEAS, MERSの経験からサイトカインストームに対する高用量ステロイドは、コロナウイルスのクリアランスを遅延し、また有害事象を増やす可能性が報告されている(10)。
トシリズマブとその作用機序
トシリズマブは、IL-6受容体に拮抗する人化モノクローナル抗体である。トシリズマブは、血液疾患のCRSを対象としたいくつかの研究で有効性を示しており(11,12)、現在では、全身性若年性特発性関節炎、関節リウマチ、巨細胞性動脈炎に加え、重症CRSの治療薬として米国FDAから承認されている。
IL-6は間質細胞および免疫系細胞(Bリンパ球、Tリンパ球、マクロファージ、単球、樹状細胞、マスト細胞、およびその他の非リンパ球)によって分泌される(13)。通常は、体内のIL-6のレベルは非常に低く、感染や傷害がある場合に、体内の防御機能を強化するために迅速に合成され、IL-6レベルが上昇する。IL-6の過剰な放出はCRSを引き起こすことがあり、CRSが重度であればあるほど、IL-6の血清ピーク濃度は高くなる。IL-6は、その受容体であるIL-6Rと結合して複合体を形成した後、シグナル伝達糖タンパク質130(gp-130)と結合してシグナル伝達を開始し、下流のシグナル伝達や遺伝子発現の引き金となる(図1)。IL6-Rは、膜結合型(mIL-6R)だけでなく、可溶性型(sIL-6R)でも存在する(14)。古典的シグナル伝達経路では、IL-6はmIL-6Rと結合して複合体を形成し、その後gp-130と結合して抗炎症作用などの下流の反応を引き起こすが、これはmIL-6Rを発現する細胞に限定される。トランスシグナル伝達経路では、IL-6はsIL-6Rおよびgp-130と複合体を形成し、mIL-6Rの非存在下で細胞内シグナル伝達を開始し、炎症作用を示す(14)。 古典的シグナル経路では、多くの細胞はIL-6Rの発現不足によりIL-6シグナルに応答できないが、これらの細胞の一部はsIL-6R-IL-6複合体により刺激されてIL-6シグナルに応答し、細胞シグナル伝達を引き起こす。トランス提示シグナルは細胞外gp-130によって抑制され、細胞外gp-130はsIL-6Rと複合体を形成して、sIL-6Rが膜結合gp-130に結合するのを防ぐことができる(15)。通常時はIL-6Rを発現する細胞に限定されているが、IL-6のレベルが高くなると、gp-130により、IL-6シグナルが広く発現するようになる。このように、sIR-6Rを介したIL-6のトランスシグナリングは、全身の細胞を活性化し、その後、前炎症反応を調節することができる。トランスシグナル伝達の遮断は、様々な慢性疾患および自己免疫疾患モデルにおいて有効であったと報告されている(16)。ヒト抗IL-6Rモノクローナル抗体であるトシリズマブは、mIL-6RとsIL-6Rの両方に結合し、古典的シグナルとトランスシグナルを阻害することができる。これは、COVID-19のサイトカインストームの治療のためのその潜在的なメカニズムである可能性がある。
COVID-19で死亡した患者では好中球数、Dダイマー値、血中尿素窒素値、クレアチニン値増加、リンパ球数減少することがわかっている(17-19)。これらはCRSによる臓器障害と考えられる。最近発表された多くの論文では、COVID-19患者の臨床的特徴を分析し、肺炎患者、特に重症肺炎患者ではリンパ球数が有意に減少し、一方で多数のサイトカイン(IL-6、IL-10、IL-2、TNFおよびIFN-γなど)が有意に増加していることを一貫して明らかにしている(17-20)。IL-6は、Bリンパ球の分化や抗体産生を誘導し、Tリンパ球の増殖や分化を誘導して体の免疫応答に関与する可能性がある。IL-6の発現量が多い炎症性CD14+CD16+単球が誘導され、炎症を加速させることがわかっている(21)。つまり、IL-6はCRSの主要なメディエーターであり、したがって、IL-6を阻害する標的薬は、CRSやサイトカインストームをブロックできる可能性がある(22)。中国ではCOVIDの治療薬として臨床検査でIL-6値が上昇し、広範な両側肺病変がある患者ではトシリズマブの使用が推奨されている。
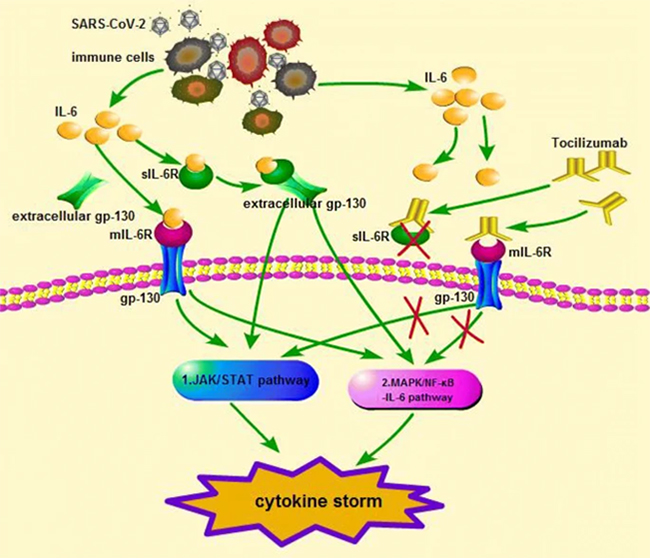
<図1 Zangらから引用(23)>
COVID-19に対するトシリズマブのエビデンス
現在までに、COVID-19患者に対するトシリズマブの有効性と安全性を検討するために、いくつかの研究が行われている(24)。対象となるCOVIDは呼吸不全をていしているものがほとんどである。
<症例報告>
- SSc患者に併発したCOVID-19をトシリズマブで治療中も問題なかったことを報告した(25)
- 腎移植後患者のCOVID-19をトシリズマブとヒドロクロロキンで治療(26)
- COVID-19患者にトシリズマブ投与でCT初見が改善(27)
- TCZ投与中の多発性骨髄腫のCOVID-19患者で所見が改善(27)
- COVID-19患者にトシリズマブ投与中に高TG血症を呈した(28)
- イタリアにおけるトシリズマブの適応外使用の3例報告。良好な転帰だった(29)
- ローカルガイドラインにもとづく投与の1例報告(30)
<ケースシリーズ>
- トシリズマブを15例に400mg/dayを投与。殆どは初日のみ投与。トシリズマブ投与前のCRP中央値は126.9mg/L(10.7〜257.9)であり、投与後は11.2mg/L(0.02〜113.7)まで低下した(p<0.01)(31)。
- 中国での80〜600mgのトシリズマブを21例に投与した報告(24,32)
- 中国での第1相試験では、両肺にびまん性病変を有するCOVID-19患者14例(最高齢は82歳、うち重症患者9例、重症患者2例)において、トシリズマブと従来治療を比較したところ、発熱を有していた11例全員が24時間以内に体温が正常化した。CT検査では、4例で肺病変の明らかな改善が認められた。
<進行中の臨床試験>
臨床試験登録サイトから、Covid-19におけるトシリズマブの治療的役割を検討している16件の研究が進行中である(24)。10件は欧州、4件は中国、2件は米国で12件は多施設無作為化臨床試験または観察的臨床試験である。研究のサンプルサイズは38〜400、累積サンプルサイズは2568人である。対象者の基準は試験によって異なり、多くの試験では呼吸不全および/またはIL-6の上昇を前提条件としている。トシリズマブの投与量は、8mg/kgが一般的に研究されている。(Table1 link)
患者の選択と管理
イタリアのガイドライン
イタリアのガイドライン(第2.0版 2020年3月12日(33))では、臨床的および/または放射線学的に急速に悪化した場合のトシリズマブの使用を支持している。投与量は8mg/kgの用量で、1回目の投与から12時間後に2回目の投与を行い、臨床反応に応じて24〜36時間後に3回目の投与のプロトコルが記載されている。使用禁忌としてトランスアミナーゼ値が正常値の上限の5倍以上、好中球数<500細胞/μL、血小板数<50,000細胞/μL、敗血症の既往、合併性憩室炎/腸管穿孔、皮膚感染症、免疫抑制剤による抗拒絶反応療法がある。
重症COVID-19患者に対するトシリズマブの安全性については、21名の患者を対象とした試験(プレプリント)が行われた。平均年齢は56.8±16.5歳で、25〜88歳の範囲であった。トシリズマブに関連した合併症はなく、病状悪化や死亡の既往はなかった。全体として、トシリズマブによる二次感染のリスクはそれほど高くないと報告している。
COVID-19の考えられるメカニズムの解析やサンプル数の少ない臨床データからは、トシリズマブは有効性が期待される。薬理経済学的な観点からは、特にIL-6が著しく上昇している重症COVID-19患者に有効性の期待が高い。こうした期待感もあってイタリアではエビデンスの不確実性が高い中で図2のアルゴリズムで治療を行っているようである。

<Medcalc.comより引用>
イタリアのガイドラインでのトシリズマブの投与基準は以下である。
<投与対象基準>
- 年齢 >18歳
- 重度の呼吸不全を伴う間質性肺炎が文書化されている(スコア=2)
- 非侵襲的人工呼吸(CPAP)または侵襲的人工呼吸(COVID呼吸器重症度スケール=3)の即時可能性のない急激な呼吸の悪化
- 非侵襲的または侵襲的な換気支援が必要となるような呼吸の悪化(COVID呼吸器重症度スケール≧3
- 高レベルのIL-6(>40pg/ml)(代替的に高レベルのDダイマー(>15000)または漸増的に増加するDダイマー
- 患者が理解し、希望する場合はインフォームドコンセントに署名し、それ以外の場合は緊急時に投与する。
中国版のガイドライン
トシリズマブは中国ではCRSには承認されていない。しかし、中国の「新規コロナウイルス肺炎の診断と治療計画(第7版)」では、肺病変が広範囲で重症な患者、臨床検査でIL-6値が高い患者にトシリズマブを使用することが推奨されている。初回投与量4〜8mg/kgの場合、400mgを0.9%塩化ナトリウム注射液で100mLに希釈し、輸液時間を1時間以上とし、初回投与量の有効性が悪い患者には、12時間後に追加投与(投与量は前回と同じ)を行い、累積投与量は2回まで、1回の投与量は800mgまでとしている。
非COVID-19に対する薬剤使用方法の推奨(米国FDA)
FDAではCRSへの投与はCAR-T細胞誘発性CRSに対してのみ承認がある(34)。
トシリズマブは、CAR-T細胞誘発性の重症または生命を脅かすCRSを有する2歳以上の成人および小児患者に対して、単独またはグルココルチコイドとの併用が推奨されている。30kg未満では12mg/kgを50mlの0.9%~0.45%食塩水に溶解、30kg以上では8mg/kgを100mlの0.9%~0.45%食塩水に溶解して使用する。CRS患者には、1回の点滴で800mgを超える投与は推奨されない。1回の点滴の持続時間は1時間以上とする。CRSの治療には皮下投与は推奨されない。1回目の投与でCRSの徴候や症状に臨床的改善が見られない場合は、トシリズマブを3回まで追加投与することができる。連続投与の間隔は少なくとも8時間とする(35)。
薬物安全性モニタリング
非COVID-19患者からのエビデンス
トシリズマブは導入以来、様々な自己免疫疾患の治療において良好な有効性と安全性を示してきた(36); (37)は、プレドニゾンとトシリズマブ(8mg/kg、4週に1回点滴静注)を併用して治療した巨細胞性動脈炎患者20例をプロスペクティブに観察し、52週の追跡調査で同様の所見を確認した(36)。
肝障害、感染症、白血球減少症を含む有害事象の頻度は21%と報告されているが、多くの研究で重篤な感染症や死亡は報告されていない(38); (36)。Giles JTらの観察研究では、RA患者でのトシリズマブの方が心血管リスクが高いと報告している。しかし、これらの研究はサンプル数が少なく、多施設大規模サンプル研究でさらに確認する必要がある。またCOVID-19の短期コース治療中に副作用が発現するかどうかは、さらに検証する必要がある。
非COCVID-19患者の使用経験から使用上は以下の点を注意すべきである
- 重篤な感染症:肺炎、尿路感染症、蜂窩織炎、帯状疱疹、胃腸炎、憩室炎、敗血症、細菌性関節炎など。
- 消化管穿孔:主に憩室炎の合併症として、全身性膿性腹膜炎、下部消化管穿孔、瘻孔、膿瘍などが報告されている。消化管穿孔を発症した患者の多くは、非ステロイド性抗炎症薬(NSAIDs)、コルチコステロイド、メトトレキサートを同時に服用していた。
- 心血管リスク:CVDイベントとの関連が言われており、慎重に投与が必要である
- 投与反応:投与中の4mg/kg及び8mg/kg投与時に最も多く報告された事象は高血圧。また。頭痛及び皮膚反応もあった。
- アナフィラキシー:一般的にトシリズマブの2回目から4回目の注入時に認められている。
- 検査値異常:血小板減少症、肝酵素上昇、脂質パラメータ(総コレステロール、LDL、トリグリセリド)上昇等。
COVID-19に対する投与上の注意点
以上のことから、トシリズマブの安全性モニタリングでは、主に以下の点が挙げられる
- 結核、細菌、侵襲性真菌、ウイルスなどの日和見感染症を含む重篤な感染症が発生し、入院または死亡に至るリスク。重篤な感染症が発生した場合には、感染症がコントロールされるまでトシリズマブの投与を中止が必要である。潜在性結核検査を実施し、陽性の場合は、トシリズマブを開始する前に結核の治療を開始する。治療中は全患者の活動性結核をモニターする
- トシリズマブは、絶対好中球数(ANC)が2×109/L未満の患者には注意して使用すべきであり、ANCが0.5×109/L未満の患者には推奨されない。トシリズマブは、血小板数が100×103/μL未満の患者には注意して使用し、血小板数が50×103/μL未満の患者には推奨しない。
- ALT又はASTが正常値の1.5倍以上に上昇した患者には、トシリズマブの投与を開始する際に注意が必要です。また、ALT、ASTが正常値の5倍以上の患者では、トシリズマブの投与を推奨しない
- 妊婦 トシリズマブは妊娠後期に胎盤に積極的に交差することが知られており、胎児の免疫反応に影響を及ぼす可能性がある。
- 腎障害のある患者 軽度の腎障害(Cockcroft-Gault 式で算出したクレアチニンクリアランス80mL/min未満、50mL/min以上)はトシリズマブの薬物動態に影響を及ぼさなかったと報告されている。巨大細胞性動脈炎の臨床試験では、患者の約3分の1がベースライン時に中等度の腎障害(クレアチニンクリアランスが30〜59mL/min)を有しており、これらの患者ではトシリズマブ曝露への影響は認められなかった。
結論
最近のCOVID-19の臨床的特徴や疾患進行のメカニズムに関する報告から、サイトカインストームが疾患の急速な進行に重要な役割を果たしていると考えられる。IL-6は感染症誘発性サイトカインストームに関与する重要なサイトカインの一つである。トシリズマブは、mIL-6RおよびsIL-6Rと結合することで下流のシグナル伝達を遮断し、COVID-19によるサイトカインストームの治療に役割を果たす可能性がある。現在、COVID-19に対するトシリズマブの使用を推奨する確信性の高いエビデンスはない。トシリズマブの臨床的使用法については、イタリアのCOVID-19のガイドライン、中国の「新型コロナウイルス肺炎の診断と治療計画(第7回試行版)」、米国FDAによるCRS治療薬の服薬指導書を参考にすることができる。トシリズマブによる重篤な感染症、好中球減少症又は血小板減少症、肝障害等のリスクに注意する。軽度又は中等度の腎不全患者ではトシリズマブの投与量を調整する必要はなく、妊婦や肝障害のある患者でのトシリズマブの使用データは不十分である。
<参考文献>
- Li Q, Guan X, Wu P, Wang X, Zhou L, Tong Y, et al. Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus-Infected Pneumonia [Internet]. Vol. 382, New England Journal of Medicine. 2020. p. 1199-207. Available from: http://dx.doi.org/10.1056/nejmoa2001316
- Statement on the second meeting of the International Health Regulations (2005) Emergency Committee regarding the outbreak of novel coronavirus (2019-nCoV) [Internet]. [cited 2020 May 1]. Available from: https://www.who.int/news-room/detail/30-01-2020-statement-on-the-second-meeting-of-the-international-health-regulations-(2005)-emergency-committee-regarding-the-outbreak-of-novel-coronavirus-(2019-ncov)
- WHO announces COVID-19 outbreak a pandemic. 2020 Mar 12 [cited 2020 May 1]; Available from: http://www.euro.who.int/en/health-topics/health-emergencies/coronavirus-covid-19/news/news/2020/3/who-announces-covid-19-outbreak-a-pandemic
- Zhao J-Y, Yan J-Y, Qu J-M. Interpretations of "Diagnosis and Treatment Protocol for Novel Coronavirus Pneumonia (Trial Version 7)" [Internet]. Chinese Medical Journal. 2020. p. 1. Available from: http://dx.doi.org/10.1097/cm9.0000000000000866
- Tisoncik JR, Korth MJ, Simmons CP, Farrar J, Martin TR, Katze MG. Into the eye of the cytokine storm. Microbiol Mol Biol Rev. 2012 Mar;76(1):16-32.
- Zhang C, Wu Z, Li J-W, Zhao H, Wang G-Q. The cytokine release syndrome (CRS) of severe COVID-19 and Interleukin-6 receptor (IL-6R) antagonist Tocilizumab may be the key to reduce the mortality. Int J Antimicrob Agents. 2020 Mar 29;105954.
- Ferrara JL, Abhyankar S, Gilliland DG. Cytokine storm of graft-versus-host disease: a critical effector role for interleukin-1. Transplant Proc. 1993 Feb;25(1 Pt 2):1216-7.
- de Jong MD, Simmons CP, Thanh TT, Hien VM, Smith GJD, Chau TNB, et al. Fatal outcome of human influenza A (H5N1) is associated with high viral load and hypercytokinemia. Nat Med. 2006 Oct;12(10):1203-7.
- Teachey DT, Lacey SF, Shaw PA, Melenhorst JJ, Maude SL, Frey N, et al. Identification of Predictive Biomarkers for Cytokine Release Syndrome after Chimeric Antigen Receptor T-cell Therapy for Acute Lymphoblastic Leukemia. Cancer Discov. 2016 Jun;6(6):664-79.
- Russell CD, Millar JE, Baillie JK. Clinical evidence does not support corticosteroid treatment for 2019-nCoV lung injury. Lancet. 2020 Feb;395(10223):473-5.
- Fitzgerald JC, Weiss SL, Maude SL, Barrett DM, Lacey SF, Joseph Melenhorst J, et al. Cytokine Release Syndrome After Chimeric Antigen Receptor T Cell Therapy for Acute Lymphoblastic Leukemia [Internet]. Vol. 45, Critical Care Medicine. 2017. p. e124-31. Available from: http://dx.doi.org/10.1097/ccm.0000000000002053
- Maude SL, Laetsch TW, Buechner J, Rives S, Boyer M, Bittencourt H, et al. Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. N Engl J Med. 2018 Feb 1;378(5):439-48.
- Danilova N. Stress Response and Immunity: Links and Trade Offs. Bentham Science Publishers; 2020. 459 p.
- Braun GS, Nagayama Y, Maruta Y, Heymann F, van Roeyen CR, Klinkhammer BM, et al. IL-6 Trans-Signaling Drives Murine Crescentic GN [Internet]. Vol. 27, Journal of the American Society of Nephrology. 2016. p. 132-42. Available from: http://dx.doi.org/10.1681/asn.2014111147
- Jones SA, Jenkins BJ. Recent insights into targeting the IL-6 cytokine family in inflammatory diseases and cancer [Internet]. Vol. 18, Nature Reviews Immunology. 2018. p. 773-89. Available from: http://dx.doi.org/10.1038/s41577-018-0066-7
- Rose-John S. The Soluble Interleukin 6 Receptor: Advanced Therapeutic Options in Inflammation [Internet]. Vol. 102, Clinical Pharmacology & Therapeutics. 2017. p. 591-8. Available from: http://dx.doi.org/10.1002/cpt.782
- Wang D, Hu B, Hu C, Zhu F, Liu X, Zhang J, et al. Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. JAMA [Internet]. 2020 Feb 7; Available from: http://dx.doi.org/10.1001/jama.2020.1585
- Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020 Feb 15;395(10223):497-506.
- Wan S, Yi Q, Fan S, Lv J, Zhang X, Guo L, et al. Characteristics of lymphocyte subsets and cytokines in peripheral blood of 123 hospitalized patients with 2019 novel coronavirus pneumonia (NCP) [Internet]. Available from: http://dx.doi.org/10.1101/2020.02.10.20021832
- Liu J, Li S, Liu J, Liang B, Wang X, Wang H, et al. Longitudinal characteristics of lymphocyte responses and cytokine profiles in the peripheral blood of SARS-CoV-2 infected patients. EBioMedicine. 2020 May;55:102763.
- Zhou Y, Fu B, Zheng X, Wang D, Zhao C, Qi Y, et al. Aberrant pathogenic GM-CSF + T cells and inflammatory CD14 + CD16 + monocytes in severe pulmonary syndrome patients of a new coronavirus. Immunology. bioRxiv; 2020.
- Tanaka T, Narazaki M, Kishimoto T. Immunotherapeutic implications of IL-6 blockade for cytokine storm. Immunotherapy. 2016 Jul;8(8):959-70.
- Zhang S, Li L, Shen A, Chen Y, Qi Z. Rational Use of Tocilizumab in the Treatment of Novel Coronavirus Pneumonia. Clin Drug Investig [Internet]. 2020 Apr 26; Available from: http://dx.doi.org/10.1007/s40261-020-00917-3
- Khan F, Fabbri L, Stewart I, Robinson K, Smyth AR, Jenkins G. A systematic review of Anakinra, Tocilizumab, Sarilumab and Siltuximab for coronavirus-related infections [Internet]. Available from: http://dx.doi.org/10.1101/2020.04.23.20076612
- Mihai C, Dobrota R, Schröder M, Garaiman A, Jordan S, Becker MO, et al. COVID-19 in a patient with systemic sclerosis treated with tocilizumab for SSc-ILD [Internet]. Vol. 79, Annals of the Rheumatic Diseases. 2020. p. 668-9. Available from: http://dx.doi.org/10.1136/annrheumdis-2020-217442
- Fontana F, Alfano G, Mori G, Amurri A, Lorenzo T, Ballestri M, et al. Covid-19 pneumonia in a kidney transplant recipient successfully treated with Tocilizumab and Hydroxychloroquine. Am J Transplant [Internet]. 2020 Apr 23; Available from: http://dx.doi.org/10.1111/ajt.15935
- Cellina M, Orsi M, Bombaci F, Sala M, Marino P, Oliva G. Favorable changes of CT findings in a patient with COVID-19 pneumonia after treatment with tocilizumab. Diagn Interv Imaging [Internet]. 2020 Mar 31; Available from: http://dx.doi.org/10.1016/j.diii.2020.03.010
- Morrison AR, Johnson JM, Ramesh M, Bradley P, Jennings J, Smith ZR. Letter to the Editor: Acute hypertriglyceridemia in patients with COVID-19 receiving tocilizumab. J Med Virol [Internet]. 2020 Apr 21; Available from: http://dx.doi.org/10.1002/jmv.25907
- Giambenedetto SD, Di Giambenedetto S, Ciccullo A, Borghetti A, Gambassi G, Landi F, et al. Off‐label Use of Tocilizumab in Patients with SARS‐CoV‐2 Infection [Internet]. Journal of Medical Virology. 2020. Available from: http://dx.doi.org/10.1002/jmv.25897
- Michot J-M, Albiges L, Chaput N, Saada V, Pommeret F, Griscelli F, et al. Tocilizumab, an anti-IL6 receptor antibody, to treat Covid-19-related respiratory failure: a case report. Ann Oncol [Internet]. 2020 Apr 2; Available from: http://dx.doi.org/10.1016/j.annonc.2020.03.300
- Luo P, Liu Y, Qiu L, Liu X, Liu D, Li J. Tocilizumab treatment in COVID-19: A single center experience. J Med Virol [Internet]. 2020 Apr 6; Available from: http://dx.doi.org/10.1002/jmv.25801
- ChinaXiv.org 中国科学院科技论文预发布平台 [Internet]. [cited 2020 May 1]. Available from: http://chinaxiv.org/abs/202003.00026
- [No title] [Internet]. [cited 2020 Apr 30]. Available from: https://www.regione.lazio.it/binary/rl_sanita/tbl_contenuti/COVID19_LG_SIMITLombardia_2.0.pdf
- [No title] [Internet]. [cited 2020 Apr 30]. Available from: https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/125276s114lbl.pdf
- [No title] [Internet]. [cited 2020 Apr 30]. Available from: https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/125276s114lbl.pdf
- Ferfar Y, Mirault T, Desbois AC, Comarmond C, Messas E, Savey L, et al. Biotherapies in large vessel vasculitis [Internet]. Vol. 15, Autoimmunity Reviews. 2016. p. 544-51. Available from: http://dx.doi.org/10.1016/j.autrev.2016.02.012
- Samson M, Devilliers H, Ly KH, Maurier F, Bienvenu B, Terrier B, et al. Tocilizumab as an add-on therapy to glucocorticoids during the first 3 months of treatment of Giant cell arteritis: A prospective study [Internet]. Vol. 57, European Journal of Internal Medicine. 2018. p. 96-104. Available from: http://dx.doi.org/10.1016/j.ejim.2018.06.008
- Nakaoka Y, Isobe M, Takei S, Tanaka Y, Ishii T, Yokota S, et al. Efficacy and safety of tocilizumab in patients with refractory Takayasu arteritis: results from a randomised, double-blind, placebo-controlled, phase 3 trial in Japan (the TAKT study) [Internet]. Vol. 77, Annals of the Rheumatic Diseases. 2018. p. 348-54. Available from: http://dx.doi.org/10.1136/annrheumdis-2017-211878
このサイトの監修者
 亀田総合病院
亀田総合病院
集中治療科部長 林 淑朗
【専門分野】
集中治療医学、麻酔科学

